Asetanylidi (C8H9NO)
- 2840
- 130
- Shawn Stanton II
Mikä on aseytanlidi?
Se asetanylide (C8H9Ei) Se on aromaattinen amidi, joka vastaanottaa useita ylimääräisiä nimiä: N-asetilaarilamiini, N-feenasetamidi ja Ateniili. Se esitetään kiinteänä wc: nä hiutaleiden muodossa, sen kemiallinen luonne on amidaa, ja sellaisenaan se voi muodostaa syttyviä kaasuja reagoidessaan voimakkaiden pelkistävien aineiden kanssa.
Lisäksi se on heikko emäs, kyky reagoida kuivausaineiden kanssa, kuten P2JOMPIKUMPI5 Nitriili. Todettiin, että asetanyylidillä oli kipulääke ja antippyrettinen vaikutus, ja sitä käytettiin vuonna 1886 Antifebriinin nimellä a. Cahn ja P. Hepp.
Vuonna 1899 markkinoille vietiin asetyylisalisyylihappo (aspiriini), joilla oli samat terapeuttiset vaikutukset kuin aseethanilidi. Kun asetanylidien käyttö liittyy syanoosin ulkonäköön potilailla - asetanyylidin indusoiman methemoglobinemian seuraus - sen käyttö hylättiin.
Myöhemmin todettiin, että asetanyylidin kipulääke ja antityreettinen vaikutus asui tämän niin nostetun parasetamolin (asetoaminofeenin) metaboliitissa, jolla ei ollut sen myrkyllisiä vaikutuksia, kuten Axelrod ja Brodie ehdottivat.
Kemiallinen rakenne

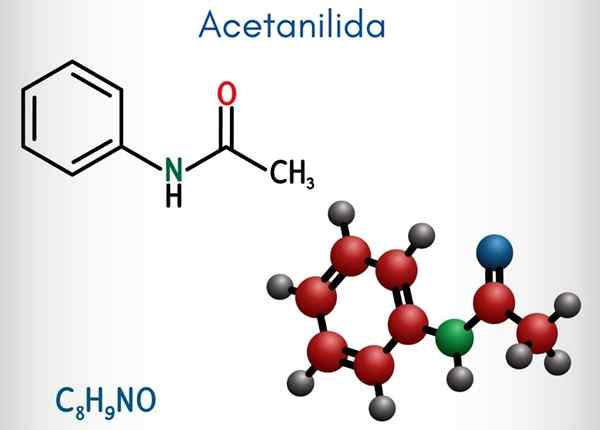
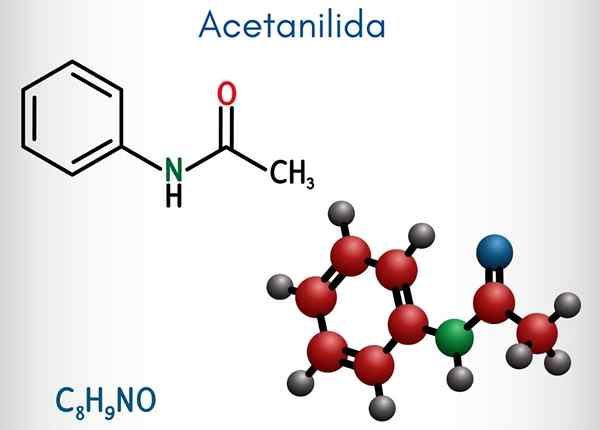
Yläkuvassa asetanyylidien kemiallinen rakenne on esitetty. Oikealla on bentseenin kuusikulmainen aromaattinen rengas (katkoviivoilla), ja vasen on syy siihen, miksi yhdiste koostuu aromaattisesta amidasta: asetamidiryhmästä (Hncoch3-A.
Asetamidiryhmä antaa bentseenirenkaan suuremman polaarisen luonteen; Eli luo dipolimomentti atetanyylimolekyylissä.
Koska? Koska typpi on elektronegatiivisempaa kuin mikään renkaan hiiliatomeista ja se on myös kytketty asyyliryhmään, jonka atomi tai houkuttelee myös elektronista tiheyttä.
Se voi palvella sinua: uretaani: rakenne, ominaisuudet, hankkiminen, käyttöToisaalta melkein koko aseutanylidin molekyylirakenne lepää samalla tasolla SP -hybridisaation vuoksi2 sen muodostavista atomeista.
On poikkeus, joka liittyy ryhmän -CH: n poikkeukseen3, joiden vetyatomit muodostavat tetraedron kärkipisteet (vasemman pään valkoiset pallot jättävät tason).
Resonanssirakenteet ja molekyylien väliset vuorovaikutukset
Yksinäinen vääntömomentti jakamatta N: n atomia kiertää aromaattisen renkaan π -järjestelmän kautta, joka on peräisin useista resonanssirakenteista. Yksi näistä rakenteista päättyy kuitenkin negatiivisella kuormalla O: n atomin (enemmän elektronegatiivista) ja positiivisella kuormalla N: n atomilla.
Siten on resonanssirakenteita, joissa negatiivinen kuorma liikkuu renkaassa, ja toinen missä se sijaitsee tai atomi. Tämän "elektronisen epäsymmetrian" seurauksena-joka tulee molekyylin epäsymmetrian kädestä-asetanyylidi on vuorovaikutuksessa molekyylien välisellä dipoli-dipolovoimilla.
Vetyjen siltojen vuorovaikutukset (N-H-O-…) kahden asetanylidimolekyylin välillä ovat kuitenkin itse asiassa vallitseva voima sen kiteisessä rakenteessa.
Tällä tavoin asetanyylidikiteet koostuvat kahdeksan molekyylin ortorromisista yksikkösoluista, jotka on suunnattu "litteiden nauhojen" kanssa vety silloillaan.
Yllä oleva voidaan visualisoida, jos aseutanylidimolekyyli asetetaan toisen päälle, rinnakkain. Joten, kuten hncoch -ryhmät3 Ne ovat päällekkäisiä aitaan, ne muodostavat vety silloja.
Lisäksi näiden kahden molekyylin välillä se voidaan "varastaa" kolmanneksi, mutta sen aromaattinen rengas osoittaa vastakkaiselle puolelle.
Voi palvella sinua: bromotimoli sininenKemialliset ominaisuudet asetanylide
 Vetoomus ulkonäkö
Vetoomus ulkonäkö Molekyylipaino
135 166 g/mol.
Kemiallinen kuvaus
Valkoinen tai harmahtava kiinteä. Muodostaa kirkkaan valkoiset hiutaleet tai kiteinen valkoinen jauhe.
Haju
Käymälö.
Maku
Hieman mausteinen.
Kiehumispiste
304 ºC - 760 mmHg (579 ºF 760 mmHg).
Sulamispiste
114,3 ºC (237,7 ºF).
Flash tai syttyvyys
169 ºC (337 ºF). Mittaus avoimessa lasissa.
Tiheys
1 219 mg/ml 15 ° C: ssa (1 219 mg/ml 59 ºF: ssa)
Höyryn tiheys
4.65 ilmansuhteella.
Höyrynpaine
1 mmHg lämpötilassa 237 ºF, 1,22 × 10-3 mmHg 25 ºC: ssa, 2a 20 ° C: ssa.
Vakaus
Se kärsii kemiallisesta takaosasta, kun se altistetaan ultraviolettivalolle. Kuinka rakenne muuttuu? Asetyyliryhmä muodostaa uusia linkkejä renkaassa orto -asennoissa ja. Lisäksi se on vakaa ilmassa ja yhteensopimattomia vahvojen hapettavien aineiden, Causticsin ja alkalin kanssa.
Volatiliteetti
Huomattavasti haihtuva 95 ºC: n lämpötilassa.
Itseohjaus
1004 ºF.
Hajoaminen
Se hajoaa kuumennettaessa, säteilemällä erittäin myrkyllistä savua.
PHE
5 - 7 (10 g/l h2Tai 25 ºC)
Liukoisuus
- Vedessä: 6,93 × 103 mg/ml 25 ° C: ssa.
- 1 g asetanyylidien liukoisuus eri nesteissä: 3,4 ml alkoholia, 20 ml kiehuvaa vettä, 3 ml metanolia, 4 ml asetonia, 0,6 ml kiehuvaa alkoholia, 3,7 ml kloroformia, 5 ml gecerolia, 8 ml Dioksan, 47 ml bentseeniä ja 18 eetteriä. Kloorihydraatti lisää asetaniilidin liukoisuutta veteen.
Synteesi
Se syntetisoidaan reagoimalla etikkahappoanhydridi asetanyylidillä. Tämä reaktio esiintyy monissa orgaanisissa kemian teksteissä (Vogel, 1959):
C6H5Nh2 + (CH3Co)2O => c6H5Nhcoch3 + CH3Haittaa
Se voi palvella sinua: Borax: Historia, rakenne, ominaisuudet, käytöt, synteesi, riskitSovellukset
- Se on vetyperoksidin hajoamisprosessin (vetyperoksidin) estäjäaine.
- Stabiloi selluloosaesterin lakkaa.
- Puuttuu välittäjänä kumituotannon kiihtyvyyteen. Samoin se on välittäjä joidenkin väriaineiden ja kamferin synteesissä.
- Se toimii esiasteena penisilliinin synteesissä.
- Sitä käytetään 4-asetamidefonilbentseenikloridin tuotannossa. Asetanylidi reagoi kloorisulfonihapon kanssa (HSO3Cl), tuottaen siten 4-aminosulfonilbentseenin kloridin. Tämä reagoi ammoniumin tai primaarisen orgaanisen amiinin kanssa sulfonamidien muodostamiseksi.
- Sitä käytettiin kokeellisesti 1800 -luvulla valokuvauksen kehittämisessä.
- Asetanylideä käytetään elektroosmoottisten virtausten (EOF) markkerina kapillaarielektroforeesissa lääkkeiden ja proteiinien välisen yhteyden tutkimiseksi.
- Äskettäin 1- (ω-fenoksialkiluracilo) on liittynyt estoon hepatiitti C-viruksen estämiskokeiden estokokeissa. Asetanylide liittyy Pyrimidiinirenkaan 3 asentoon 3.
- Koetulokset osoittavat virusgenomin replikaation vähenemisen virusgenotyypistä riippumatta.
- Ennen aseutanylidin toksisuuden tunnistamista sitä käytettiin kipulääkkeenä ja antidyreettisenä vuodesta 1886. Myöhemmin (1891) sitä käytettiin Grünin kroonisen ja akuutin keuhkoputkentulehduksen hoidossa.