Konseptin vähentämisaine, vahvin, esimerkit

- 1427
- 383
- Sheldon Kuhn
Eräs vähentävä aine Se on aine, joka täyttää hapettumisaineen vähentämisen funktion oksidin vähentämisreaktiossa. Pelkistävät aineet ovat luonteeltaan elektronien luovuttajia, tyypillisesti aineita, jotka ovat alhaisimmillaan hapettumisasteella ja suurella määrällä elektroneja.
On kemiallinen reaktio, jossa atomien hapetustilat vaihtelevat. Näihin reaktioihin liittyy komplementaarinen pelkistys- ja hapetusprosessi. Näissä reaktioissa yksi tai useampi yhden molekyylin, atomin tai ionin elektronit siirretään toiseen molekyyliin, atomiin tai ioniin. Tämä tarkoittaa oksidin vähentämisreaktion tuotantoa.

Oksidin vähentämisprosessin aikana sitä elementtiä tai yhdistettä, joka menettää (tai DONA) sen elektronia (tai elektroneja), kutsutaan pelkistäväksi aineeksi, joka on vastakohtana sen hapettavan aineen kanssa, joka on elektronireseptori. Sitten sanotaan, että pelkistävät aineet vähentävät hapettavaa ainetta ja että hapettava aine hapettaa pelkistävän aineen.
Parhaat tai voimakkaimmat pelkistävät aineet ovat ne, joilla on suurin atomiradio; Eli heillä on suurempi etäisyys ytimestään samoja ympäröiviin elektroneihin.
Pelkistävät aineet ovat yleensä metalli- tai negatiivisia ioneja. Yleisiä pelkistäviä aineita ovat askorbiinihappo, rikki, vety, rauta, litium, magnesium, mangaani, kalium, natrium, C -vitamiini, sinkki ja jopa porkkanauute.
[TOC]
Mitkä ovat vähentävät edustajat?
Kuten jo sanottiin, vähentävät aineet ovat vastuussa hapettavan aineen vähentämisestä, kun oksidin vähentämisreaktio tapahtuu.
Oksidin vähentämisreaktion yksinkertainen ja tyypillinen reaktio on aerobinen solujen hengitys:
Voi palvella sinua: alumiinihydridi (ALH3): rakenne, ominaisuudet, käyttötarkoituksetC6H12JOMPIKUMPI6(s) + 6o2(g) → 6Co2(g) + 6h2Tai (l)
Tässä tapauksessa glukoosi (c6H12JOMPIKUMPI6) reagoi hapen kanssa (tai2), Glukoosi käyttäytyy pelkistävänä aineena, joka antaa elektroneja happea - eli se hapetetaan - ja happea tulee hapettuvaa ainetta.
Orgaanisessa kemiassa parhaita pelkistäviä aineita pidetään reagenssina, jotka tarjoavat vetyä (H2) reaktioon. Tällä kemian alalla pelkistysreaktio viittaa vedyn lisäämiseen molekyyliin, vaikka aikaisempi määritelmä (oksidin vähentämisreaktiot sovelletaan myös.
Tekijät, jotka määrittävät pelkistävän aineen voiman
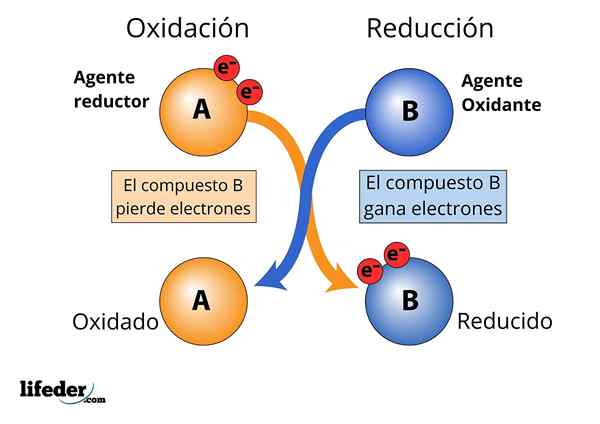 Hapettava ja pelkistävä aine, elektronien menetys ja vahvistus havaitaan
Hapettava ja pelkistävä aine, elektronien menetys ja vahvistus havaitaan Jotta ainetta pidetään "vahvana".
Tätä varten on olemassa useita tekijöitä, jotka on otettava huomioon voiman tunnistamiseksi, joita pelkistävällä aineella voi olla: elektronegatiivisuus, atomisäde, ionisaatioenergia ja pelkistyspotentiaali.
Elektronegatiivisuus
Elektronegatiivisuus on ominaisuus, joka kuvaa parin elektronien houkuttelemisen taipumusta, joka on yhdistynyt itseään. Mitä korkeampi elektronegatiivisuus, sitä suurempi atomi kohdistaa ympäröivien elektronien ympärille.
Määräaikaisessa taulukossa elektronegatiivisuus kasvaa vasemmalta oikealle, joten emäksiset metallit ovat vähiten elektronegatiivisia elementtejä.
Atomiradio
Atomien määrän mittaa. Se viittaa atomi ytimen keskuksen tyypilliseen tai keskimääräiseen etäisyyteen sitä ympäröivän elektronisen pilven reunaan.
Voi palvella sinua: Nitriitit: Ominaisuudet, rakenne, nimikkeistö, muodostuminenTämä ominaisuus ei ole tarkka - ja lisäksi useita sähkömagneettisia voimia on mukana sen määritelmässä - mutta tiedetään, että tämä arvo laskee vasemmalta oikealle ja kasvaa ylhäältä alaspäin. Siksi alkalimetallit, erityisesti cesium, pidetään suuremmassa atomiradiossa.
Ionisaatioenergia
Tämä ominaisuus määritellään energiaksi, jota tarvitaan vähemmän yhtenäisen elektronin poistamiseksi atomista (Valencia Electron) kationin muodostamiseksi.
Sanotaan.
Ionisaatioenergia kasvaa oikeanpuoleisen vasemmalta ja alhaalta ylöspäin tapahtuvassa taulukossa. Metallien (erityisesti alkali) on jälleen vähemmän ionisaatioenergiaa.
Vähennyspotentiaali
Kemiallisten lajien taipumus on saada elektroneja ja siksi vähennetään. Jokaisella lajilla on luontainen pelkistyspotentiaali: mitä suurempi potentiaali, sitä suurempi sen affiniteetti elektronien kanssa ja myös sen kyky vähentää.
Pelkistävät aineet ovat niitä aineita, joilla on vähemmän pelkistyspotentiaalia, johtuen niiden pienestä affiniteetista elektroneihin.
Vahvemmat pelkistävät edustajat
Edellä kuvattujen tekijöiden avulla voidaan päätellä, että "vahvan" pelkistävän aineen, atomin tai molekyylin, jolla on alhainen elektronegatiivisuus, korkea atomisäde ja alhainen ionisaatioenergia, löytämiseksi halutaan.
Kuten jo mainittiin, alkalimetallit esittävät nämä ominaisuudet ja niitä pidetään vahvimmin pelkistävinä aineina.
Voi palvella sinua: alifaattiset hiilivedyt: ominaisuudet, nimikkeistö, reaktiot, tyypitToisaalta litiumia (LI) pidetään voimakkaimpana pelkistävänä aineena, jolla on alhaisin pelkistyspotentiaali, kun taas Lialh -molekyyli4 Sitä pidetään kaikkien voimakkaimpana pelkistävänä aineena tämän ja muiden haluttujen ominaisuuksien sisällyttämiseksi.
Esimerkkejä reaktioista pelkistävien aineiden kanssa
Jokapäiväisessä elämässä on monia oksidien vähentämistä. Alla on joitain edustavia:
Esimerkki 1
Oktaanin (bensiinin pääkomponentti) palamisreaktio:
2 c8H18(l) + 25o2 → 16Co2(g) + 18H2O (g)
Voit nähdä, kuinka oktaaniaine (pelkistävä aine) Dona -happielektronit (hapettava aine), hiilidioksidin ja veden muodostaen suurina määrinä.
Esimerkki 2
Glukoosihydrolyysi on toinen hyödyllinen esimerkki yleisestä pelkistyksestä:
C6H12JOMPIKUMPI6 + 2ADP + 2P + 2NAD+ → 2Ch3Kookospähkinä2H + 2ATP + 2NADH
Tässä reaktiossa NAD -molekyylit (elektronireseptori ja hapettava aine tässä reaktiossa) ottavat glukoosielektroneja (pelkistävä aine).
Esimerkki 3
Lopuksi rautaoksidin reaktiossa
Usko2JOMPIKUMPI3(s) + 2Al (s) →2JOMPIKUMPI3(s) + 2fe (l)
Pelkistävä aine on alumiini, kun taas hapettumisaine on rauta.
Viitteet
- Wikipedia. (S.F.-A. Wikipedia. Saatu.Wikipedia.org
- BBC. (S.F.-A. BBC.yhteistyö.Yhdistynyt kuningaskunta. Saatu BBC: ltä.yhteistyö.Yhdistynyt kuningaskunta
- Pearson, D. (S.F.-A. Kemian librettexts. Saatu kemikolta.Librettexts.org
- Tutkimus, b. (S.F.-A. Bodner Research Web. Saatu Murmedilta.Kemia.Purduke.Edu
- Peter Atkins, L. J -. (2012). Kemialliset periaatteet: Etsintä oivalluksiin.
- « Cassia angustifolia -ominaisuudet, valmistelu, vasta -aineet
- Atsimutaaliset projektioominaisuudet, tyypit, edut, haitat »

