Etyylialkoholirakenne, ominaisuudet, käytöt, hankkiminen
- 2229
- 185
- Edgar VonRueden
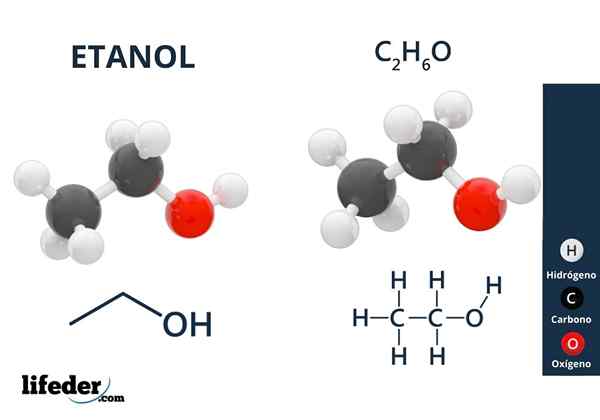
Hän Etyylialkoholi tai etanoli Se on orgaaninen yhdiste, jonka kaava on c2H5Voi tai ch3CH2Voi, esittelee itsensä värittömänä nesteinä. Tämä on kaikkien metanolin jälkeen toinen yksinkertaisin ensisijainen alkoholi. Se on hyvin liukoinen veteen ja monissa orgaanisissa liuottimissa, mikä on mahdollistanut monien sen sovellusten kehittämisen.
Tätä alkoholia on käytetty antiseptisenä ja desinfiointiaineena, sen lisäksi, että se käyttää lääkkeiden ja muiden orgaanisten kemikaalien synteesissä. Sitä on käytetty myös polttoaineena lämmittimessä, lamppuissa ja yhdessä moottoriajoneuvojen bensiinin kanssa.

Sokerin käyminen etanolin tuotannossa on yksi ensimmäisistä kemiallisista reaktioista, jotka alkeellisessa ihmisessä oppi. Kiinasta on löydetty 9000 vuoden kulmakeraamista.
Mutta sokerit käyminen tuotti vain erittäin alhaisen pitoisuuden etanoliliuoksen, minkä vuoksi oli tarpeen oppia tislaustekniikoita veden poistamiseksi ja alkoholin keskittymiseksi. Siten kreikkalaiset alkemistit, jotka työskentelivät Alexandriassa 1. vuosisadalla.C., He tiesivät ja käyttivät tislausta.
On kuitenkin synteettisiä reittejä, jotka sallivat täysin puhtaan etanolin saamisen etyleeniin, joka on tislattu öljystä. Siksi öljy on epäsuora etanolin lähde. Tällä tavoin saadaan etanoli tai absoluuttinen alkoholi.
[TOC]
Etyylialkoholirakenne
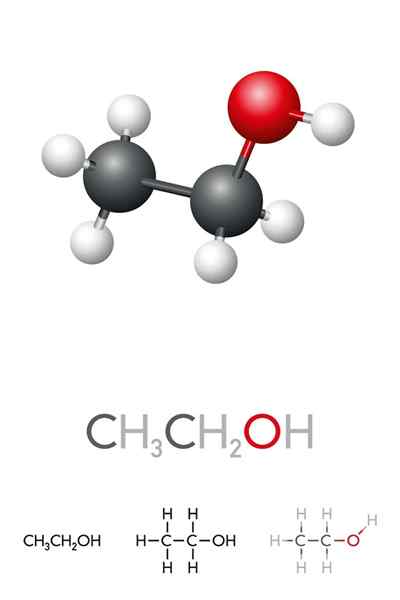
Ylemmässä kuvassa meillä on etanolin molekyylirakenne, Cho3-CH2-Voi, edustama koko avaruusmalli. Se on melko polaarinen molekyyli, koska OH -ryhmä houkuttelee elektronista tiheyttä hiilirungon itseään kohtaan, johon se on linkitetty.
Seurauksena on, että etyylialkoholimolekyylit ovat vuorovaikutuksessa dipoli-dipolin kautta3CH2Oh-ohch2CH3. Siksi tällä alkoholilla on korkea kiehumispiste verrattuna muihin orgaanisiin liuottimiin tai nesteisiin.
Ominaisuudet
Fyysinen ulkonäkö
Väritön neste.
Moolimassa
46.069 g/mol
Haju
Pehmeä haju ja samanlainen kuin viini.
Maku
Polttaa.
Tiheys
0 -.789 g/cm3 20 ºC
Sulamispiste
- 114,14 ºC
Kiehumispiste
78,24 ºC
Vesiliukoisuus
1 · 106 mg/l. Eli se on käytännössä sekoittuu kaikissa mittasuhteissa.
Sekoittuvuus orgaanisten liuottimien kanssa
Etanoli sekoittuu etikkahappoon, asetoniin, bentseeniin, hiilitetrakloridiin, kloroformiin, dietyl -eetteriin, etyleeniglykoliin, glyseroliin, pyridiiniin ja tolueeniin. Se sekoittuu myös kevyiden alifaattisten hiilivetyjen, kuten Pentanon ja Hexanon kanssa.
Oktanoli/vesijakokerroin
Loki p = - 0.31
Höyrynpaine
59.3 mm Hg 25 ° C: ssa. Siksi hylkäsi havaittavan määrän höyryjä.
Voi palvella sinua: bariumkloridi (BACL2)Höyryn tiheys
1.59 Ilmasuhteessa yksikkönä (1)
sytytyspiste
13 ºC
Itsensuuntainen lämpötila
363 ºC
Palamislämpö
1336.8 kJ/mol A 25 ºC
Palaminen
Etanoli on haihtuva neste, joka palaa sinisellä liekillä, ilman savua, ja se on käytännössä näkymätöntä luonnolliselle valolle.
Erityinen lämpö
0 -.618 kalkki/g 23 ° C: ssa
Goo
1.2 MPa · S 20 ºC: n lämpötilassa
Taitekerroin ηD
1.3611
Etyylialkoholin käyttö
 Yksi alkoholin yleisimmistä käytöistä on kuin antiseptinen
Yksi alkoholin yleisimmistä käytöistä on kuin antiseptinen Lääketieteelliset käyttötarkoitukset
Antiseptinen
Etanolia käytetään antiseptisenä, koska sillä on tappava vaikutus bakteereja ja sieniä vastaan. Se pystyy muuttamaan plasmamembraanien rakennetta, joka tuottaa tuhoamisen osmoottisten vesivirtojen kautta.
Samoin etanoli voi tuhota monen tyyppisiä viruksia. Tällä hetkellä suositellaan geelien käyttöä, jotka sisältävät alkoholia kätensä desinfiointiin ja leviämisen vähentämiseen koronaviruksen kanssa. Etanolia käytetään myös pinnallisten pienten haavojen desinfioinnissa.
Huumeiden liuotin
Monet lääkkeet ovat vähän liukenevia veteen, etanolin avulla niiden liukoisuuden lisäämiseksi. Joidenkin yskä- ja suun huuhtelujen narujen etanoli on enintään 25%.
Kipuhoito
Etanolia käytetään hermojen tai ganglioiden terapeuttiseen hajoamiseen kroonisen tyydyttämättömän kivun lievittämiseksi, joka on läsnä käyttökelvottomassa syövässä tai kolmoishermossa.
Oireenmukainen kilpirauhasen kystat
Kilpirauhasen hoidossa käytetään perkutaanisia etanoli -injektioita, yksinkertainen toimenpide, joka voisi välttää kirurgisen intervention komplikaatioita.
Rauhoittava vaikutus
Toisinaan etanolia annetaan laskimonsisäisesti preoperatiivisen ja postoperatiivisen sedaation kannalta potilailla, joille muut toimenpiteet eivät ole käyttökelpoisia.
Vasta -aine
Etanolia käytetään systeemisesti myrkytyksen käsittelemiseen metanolilla tai eteeni -glykolilla.
Glaukooma
Etanolia käytetään vähentämään silmänpainetta glaukoomapotilailla.
Polttoaine
Yhdysvallat kuluttaa yhdessä Brasilian kanssa 90% etanolista, jota käytetään polttoaineena autoissa. Yhdysvallat on maailman suurin maissintuottaja, joten se käyttää maissia etanolin lähteenä polttoaineena.
Government tukee maissinviljelijöitä, jotka kasvoivat vuosina 1979 - 1986 20 miljoonan gallonan polttoaineen etanolin tuotanto 750 miljoonaan gallonaan.
Sokeriruoko on tärkein etanolilähde Brasiliassa käytettäväksi polttoaineena. Vuonna 1943 toisen maailmansodan takia.
Voi palvella sinua: DeuteriumVuodesta 1976 lähtien niitä on käytetty polttoaineena etanolin ja bensiinin seoksissa, joiden etanolipitoisuus on välillä 10–25 %, sokeriruo'on tuotannosta riippuen.
Virkistyskäyttö
Etanolia on läsnä lukuisissa juomissa, joita käytetään sosiaalisissa kokouksissa ja jopa lounaalla ja perheen illallisella.
Alkoholin alkuperäinen toiminta ihmisen sosiaalisen käyttäytymisen estämiseksi tuottaa miellyttävän ja helpottavan ympäristön ihmisten välisestä vuorovaikutuksesta. Ylimääräinen etanoli voi kuitenkin räjäyttää myrkyllisiä ja ei -toivottuja vaikutuksia henkilökohtaiseen terveyteen ja kokousten tai tapahtumien väliseen harmoniaan.
Henkilökohtainen hygienia
Etanolia on läsnä monissa kosmetiikoissa ja kauneustuotteissa. Lisäksi sen supistavan vaikutuksen vuoksi sitä käytetään ihonpuhdistuksessa, rasvan ja likaisen jäännöksen poistaminen, että vesi ja saippua eivät tee sitä. Se on myös osa monien voiteiden ja hajusteiden valmistelua.
Ruoka
Vaniljan, kakkujen ja kakkujen käytön maku, liuotetaan etanolin ja veden seokseen. Makeit, jotka ovat täynnä tiettyjä alkoholijuomia. Alkoholia käytetään myös joidenkin makeisten makuun.
Etyylialkoholin saaminen
Etanolia saadaan pääasiassa sokerin käymisellä ja eteenihydraatiolla, harjoittelemalla sen tuottamiseksi hiilidioksidista, lipideistä ja selluloosasta.
Käyminen
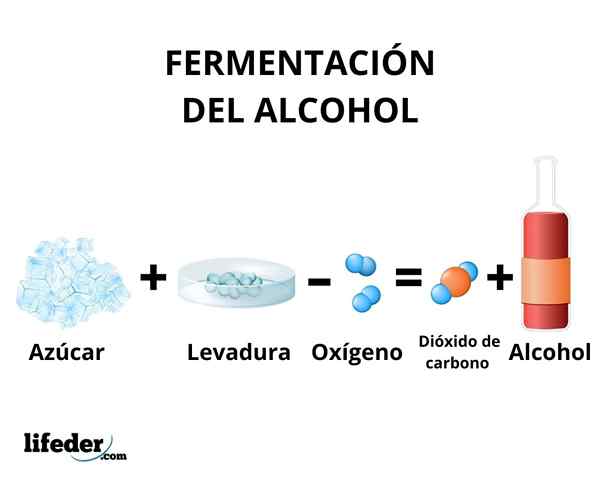
Käymisprosessissa hiilihydraattien muuntaminen etanolissa tapahtuu hiivassa olevien entsyymien vaikutuksella. Pääasiassa sokeriruo'on, juurikkaiden ja viljojen, kuten maissin ja ohran, käytetään raaka -aineena.
Joidenkin hiivalajien, kuten Saccharomyces cerevisiae, He kykenevät toimimaan glukoosi- ja sakkaroosisokereissa etanolin tuottamiseksi. Tuotettua etanolin pitoisuutta rajoittaa hiivojen herkkyys etanolille.
Joka tapauksessa käymisellä tuotettu etanolin pitoisuus ei ylitä 18%. Etanoliliuos on välttämätöntä keskittää yksinkertaisella tislauksella. Tämän menetelmän avulla etanoliliuos saadaan pitoisuudella noin 95%.
Lopuksi käytetään fraktioitua tislausta ja 95% alkoholin kuivumista absoluuttisen alkoholin tuotannossa. Fermentoinnilla tuotettua etanolia käytetään lääketieteessä, ja se on varattu polttoaineena, joka täydentää bensiiniä.
Etyleenihydraatio
Tässä prosessissa etyleeni sekoitetaan korkeiden lämpötilojen kanssa, joissa on deionisoitu höyry korkeissa lämpötiloissa, välillä 250 - 300 ° C ja paineen 6 alaisena.8 MPa. Eteenin muuntamista etanoliksi katalysoi piidioksidi- tai piiman maaränkyyn asetettu fosforihappo.
Voi palvella sinua: metallien mekaaniset ominaisuudetEtyleenihydraatioreaktio voidaan kaavioida seuraavasti:
C2H4 + H2O → ch3CH2vai niin
Osa fosforihaposta vedetään vesihöyryllä ja ne neutraloida laimennetulla natriumhydroksidilla. Etyleenihydraatiolla saatu etanolipitoisuus on alhainen, arvon välillä 10 - 25%.
Sitten etanoliliuos konsentroituu tislaamalla, saadaan 95 -prosenttinen etanoliliuos, joka voidaan suorittaa 100%: lla fraktiota tislauksella ja kuivumisella.
Muut menetelmät
Vaihtoehtoisista etanolin tuotantomenetelmistä meillä on hiilidioksidi, lipidit ja selluloosa. Selluloosan käyttö on lupaavampaa, koska materiaalit, kuten puu, olki, jätepaperit jne., Selluloosan raaka -aineen lähteenä. Selluloosa on glukoosipolymeeri ja sitä voidaan käyttää tämän hiilihydraatin lähteenä.
Toksisuus ja riskit
 Kotitekoisia alkoholiveneitä löytyy yleensä 70–90%: n pitoisuudesta
Kotitekoisia alkoholiveneitä löytyy yleensä 70–90%: n pitoisuudesta Inhalaatio
Korkeat etanolihöyryn pitoisuudet voivat aiheuttaa uneliaisuutta, silmien ärsytystä ja ylähengitysteitä, jotka ilmenevät yskä ja päänsärky.
Suora kosketus ihon ja silmien kanssa
Ihon kosketus voi aiheuttaa kuivumista ja kroonista, ärsytystä ja ihottumaa. Sillä välin silmäkontakti tuottaa ärsytystä, punoitusta, kipua ja polttavan sensaation.
Nieleminen
Tuottaa palavan sensaation ja aluksi sillä on stimuloiva ja miellyttävä vaikutus tuotetusta estosta. Mutta kun alkoholin saanti jatkuu, siellä on hermo masennus, päänsärky, hämärtynyt näkö, uneliaisuus ja tajuttomuus.
Krooniset vaikutukset
Etanoli vaikuttaa keskushermostoon ja ylähengitysteihin. Lisäksi etanolin nauttimisen aiheuttamat maksavauriot voivat johtaa maksakirroosiin ja myöhemmin kuolemaan.
Viitteet
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10th Painos.-A. Wiley Plus.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Morrison ja Boyd. (1987). Orgaaninen kemia. (Viides painos). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Etanoli. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2020). Etanoli. Pubchem Comunundin yhteenveto CID 702: lle. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Etanolihistoria. (2011). Etanolihistoria - alkoholista autopolttoaineeseen. Toipunut: etanolhistoria.com
- Enyclopaedia Britannica -toimittajat. (2020). Etanoli. Toipunut: Britannica.com
- Corquiven. (15. lokakuuta 2000). Turvaarkki (MSD) etyylialkoholi. [PDF]. Toipunut: iio.Etu.UABC.MX
- Byju. (2020). Metanolin ja etanolin käyttö. Toipunut: byjus.com
- Helmestine, Anne Marie, PH.D -d. (25. elokuuta 2020). Ero alkoholin ja etanolin välillä. Toipunut: Admingco.com

