Alosterismin yleiset näkökohdat, toiminnot ja esimerkit

- 2301
- 704
- Joshua Emmerich
Hän Alosterismi o Alostrinen säätely määritellään säätelevän molekyylin välittämän entsyymin estämisprosessiksi, joka on erilainen kuin sen substraatti ja toimii sen rakenteen tietyssä paikassa, erilainen kuin saman aktiivinen kohta.
Termi "alosteri" tai "alosterismi" tulee kreikkalaisista juurista "allot ", mikä tarkoittaa "toista" ja "Stereós", mikä tarkoittaa "muoto" tai "paikka"; Joten kirjaimellisesti kääntyy "muuksi avaruudeksi", "toinen paikka" tai "toinen rakenne".
 Aosteisen sääntelyn graafinen kaavio. (A) aktiivinen sivusto. (B) Alosteerinen paikka. C) substraatti. (D) estäjä. E) entsyymi. (Lähde: Isaac Webb [CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Wikimedia Commonsin kautta)
Aosteisen sääntelyn graafinen kaavio. (A) aktiivinen sivusto. (B) Alosteerinen paikka. C) substraatti. (D) estäjä. E) entsyymi. (Lähde: Isaac Webb [CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Wikimedia Commonsin kautta) Jotkut kirjoittajat kuvaavat alosterismia prosessina, jolla järjestelmän etäkohdat (esimerkiksi entsyymin rakenne) kytketään energisesti toiminnallisen vasteen aikaansaamiseksi, minkä vuoksi voidaan olettaa, että muutos alueella voi vaikuttaa mihin tahansa muuhun samassa.
Tämän tyyppinen säätely on tyypillinen entsyymeille, jotka osallistuvat useisiin tunnettuihin biologisiin prosesseihin, kuten signaalinsiirtoon, aineenvaihduntaan (anabolismi ja katabolismi), geneettisen ekspression säätely, muun muassa muun muassa.
F: n ensimmäiset ideoita alosterismista ja heidän osallistumisestaan solujen aineenvaihdunnan hallintaan postuloitiin 1960 -luvulla F -luvulla F. Monod, f. Jacob ja J. Changeux tutkiessaan erilaisten aminohappojen biosynteettisiä reittejä, jotka estettiin lopputuotteiden kertymisen jälkeen.
Vaikka ensimmäinen julkaisu tässä suhteessa liittyi geneettisen säätelyn kanssa, Wyman ja Channesux laajensivat vähän aikaa myöhemmin monodia, Wyman ja Channesux laajensivat alosterismin käsitystä proteiineihin, joilla on entsymaattinen aktiivisuus, ja ehdottivat mallia, joka perustuu multimeerisiin proteiineihin, pääasiassa alayksiköiden välisissä vuorovaikutuksissa, kun minkään näistä liittyi efektoriin.
Voi palvella sinua: Guanina: Ominaisuudet, rakenne, koulutus ja toiminnotMonilla myöhemmillä käsitteillä oli perusta "indusoidun sopeutumisen" teoriassa, jonka Koshland esitteli muutama vuosi ennen.
[TOC]
Yleiset ominaisuudet
Yleensä kaikilla entsyymeillä on kaksi erilaista kohtaa Ligand Unionille: Yksi tunnetaan aktiivisena kohdan, joka liittyy molekyyleihin, jotka toimivat substraattina (vastaa entsyymin biologisesta aktiivisuudesta), ja toinen on toinen tunnetaan theosteeriksi sivusto, joka on erityinen muille metaboliitteille.
Näitä "muita metaboliitteja" kutsutaan aleshiac -efektoreiksi, ja niillä voi olla positiivisia tai negatiivisia vaikutuksia entsyymien katalysoimien reaktioiden nopeuteen tai affiniteettiin, joihin ne liittyvät substraateihinsa aktiivisessa kohdassa.
Entsyymipaikka aiheuttaa yleensä efektorin liiton AL: iin.
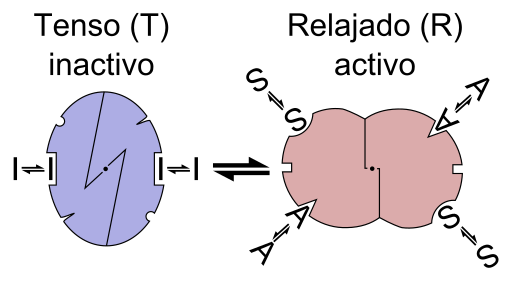 Entsyymin reaktion graafinen kaavio (lähde: Tiedosto: Entsyymi allostery on.PNG: Tiedosto: Entsyymi allostery.PNG: Allostery.PNG: Nicolas Le Novere (Talk).Lenov.Wikipediaderivatiivityö: Timvickers (Talk) johdannainen työ: Rtama (Talk) Johdannainen työ: Kes47 [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0) Wikimedia Commonsin kautta)
Entsyymin reaktion graafinen kaavio (lähde: Tiedosto: Entsyymi allostery on.PNG: Tiedosto: Entsyymi allostery.PNG: Allostery.PNG: Nicolas Le Novere (Talk).Lenov.Wikipediaderivatiivityö: Timvickers (Talk) johdannainen työ: Rtama (Talk) Johdannainen työ: Kes47 [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0) Wikimedia Commonsin kautta) Toisin sanoen alestro -efektorin liittäminen sen erityiseen paikkaan entsyymin rakenteessa aiheuttaa muutoksen entsyymin molekyyligeometriassa, joka tunnetaan siirtymisenä teosteraksi, ts. Se on tapahtuma, joka välitetään Koko makromolekyylissä muuttamalla sen käyttäytymistä.
Alosterismi voi olla homotrooppista tai heterotrooppista. Homotrooppinen alostroic -säätelyprosessi määritellään sellaiseksi, jossa sama entsyymin substraatti toimii sen alestrisen säätelijänä, ts. Alosteerinen efektori on sama substraatti; Se tunnetaan myös eräänlaisena osuuskuntana.
Heterotrooppinen säätelyprosessi puolestaan viittaa entsyymin aktiivisuuden säätelyyn, jota välittää molekyyli tai efektori, joka eroaa sen substraatista, ja sillä voi olla myös positiivisia tai kielteisiä vaikutuksia entsyymin aktiivisuuteen.
Se voi palvella sinua: Aptenia cordifolia: ominaisuudet, elinympäristö, ominaisuudet, viljelyFunktiot
Alosterismi yhdessä geneettisen ekspression, translaation ja proteiinien hajoamisen säätelyn kanssa on yksi perustavanlaatuisista mekanismeista suuren määrän orgaanisten prosessien säätelemiseksi, mikä on välttämätöntä homeostaasin ylläpitämiselle ja kaikkien elävien, yksisoluisten tai monisoluisten ylläpitämiseksi, yksisoluinen tai monisoluinen olennot.
Tostaalinen säätely tai alosterismi antaa eläville organismeille kyvyn reagoida suurella herkkyydellä säätelyligandien pitoisuuden muutoksille, samoin kuin lähtökohdat rytmisistä ilmiöistä solutasolla.
Koska energia- ja aineenvaihduntasubstraatit ovat äärellisiä solussa, alosterismi sallii aineenvaihdunnan kentällä resurssien kohtalaisen käytön välttäen sekä hyödytöntä sykliä että energian tuhlausta substraattien liiallisesta prosessoinnista runsauden tai pulan olosuhteissa.
Samoin tällä säätelymekanismilla on suuri merkitys solun signalointiprosesseille, joissa monien ligandien yhdistäminen aiheuttavat monet konformaatiomuutokset kyseisten reseptoreiden tietyissä paikoissa ovat mukana.
Esimerkkejä alosterismista
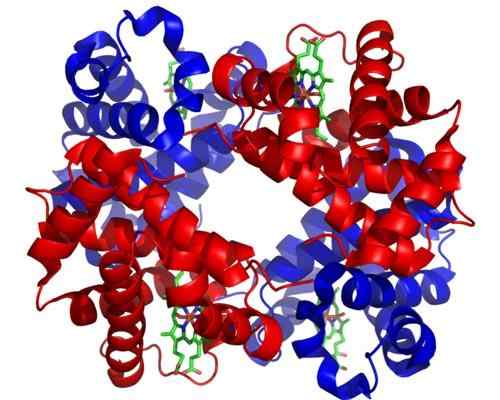 Hemoglobiini. Otettu ja muokattu osoitteesta: Zephyris englannin kielellä Wikipedia [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]].
Hemoglobiini. Otettu ja muokattu osoitteesta: Zephyris englannin kielellä Wikipedia [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]. Vaikka luonnon toosterismista tai sääntelystä on tuhansia esimerkkejä, jotkut ovat olleet näkyvämpiä kuin toiset. Näin on hemoglobiini, joka oli yksi ensimmäisistä syvyydessä kuvattuista proteiineista rakenteellisessa näkökulmassa.
Hemoglobiini on erittäin tärkeä proteiini monille eläimille, koska se on vastuussa hapen kuljetuksesta veren läpi keuhkoista kudoksiin. Tämä proteiini esittelee homotrooppista ja heterotrooppista säätelyä samanaikaisesti.
Voi palvella sinua: Saltacionismi: Ominaisuudet, todisteet ja esimerkitHemoglobiinin homotrooppinen alosterismi liittyy happimolekyylin liiton kanssa yhteen alayksiköihin, jotka muodostavat sen suoraan affiniteettiin, jonka kanssa toisen happimolekyylin vieressä oleva alayksikkö sitoutuu, lisäämällä sitä (positiivinen tai yhteistyö.
Heterotrooppinen heterotrooppinen
Heterotrooppinen alosterismi puolestaan liittyy sekä pH: n ja 2,3-diffoglysereen esiintymisen vaikutuksiin hapen liitossa tämän entsyymin alayksiköihin, estäen sitä, estäen sitä.
Pyrimidiinisynteesireitille osallistunut transkarbamilaasi tai ATCASA -aspartaatti on myös yksi ”klassisista” esimerkeistä alosteerisen säätelyn suhteen. Tämä entsyymi, jolla on 12 alayksikköä, joista 6 on katalyyttisesti aktiivinen ja 6 on säätelijöitä, estävät heterotrooppisesti pään pääte, syytidininatrifosfaatti (CTP), (CTP) (CTP).
Laktoosioperoni JA. koli
Monodin, Jacobin ja Changeauxin ensimmäisten ideoiden hedelmät olivat Jaakobin ja Monodin julkaisema artikkeli, joka liittyi laktoosin laktoosin laktoosiin Escherichia coliYllyttää, joka on yksi tyypillisistä heterotrooppisista ja geneettisen tason säätelyesimerkeistä.
Tämän järjestelmän tostaalinen säätely ei liity kykyyn muuntaa substraatti tuotteeksi, vaan proteiinin liiton affiniteettiin toimivaan DNA -alueeseen.
Viitteet
- Changex, J. P., & Edelstein, S. J -. (2005). Signaalinsiirron allosteeriset mekanismit. Science, 308 (5727), 1424-1428.
- Goldbeter, a., & DuPont, G. (1990). Allosteerinen sääntely, yhteistyö ja biokemialliset värähtelyt. Biofysikaalinen kemia, 37 (1-3), 341-353.
- Jiao, W., & Parker, ja. J -. (2012). Käyttämällä laskennallisten ja kokeellisten tekniikoiden koostumista proteiinin allosteryn molekyylipohjan ymmärtämiseksi. Proteiinikemian ja rakennebiologian edistyksessä (Vol. 87, s. 391-413). Akateeminen lehdistö.
- Kern, D., & Zuiderweg, ja. R -. (2003). Dynamiikan rooli allosteerisessa säätelyssä. Nykyinen mielipide rakenteellisessa biologiassa, 13 (6), 748-757.
- Laskowski, r. -Lla., Gerick, f., & Thornton, J. M. (2009). Proteiinien allosteerisen säätelyn rakenteellinen perusta. FEBS Letters, 583 (11), 1692-1698.
- Mathews, c. K -k -., Van Holde, K. JA., & Ahern, k. G. (2000). Biokemia, Ed. San Francisco, Kalifornia.
- « Hiilinanoputkien rakenne, ominaisuudet, sovellukset, toksisuus
- Mukautuva säteilyprosessi, tyypit ja esimerkit »

