Ampettarit, jotka ovat, tyypit ja esimerkit
- 2907
- 678
- Shawn Stanton II
Se Amfosterit Ne ovat yhdisteitä tai ioneja, joilla on erityispiirteet, jotka pystyvät käyttäytymään happona tai emäksenä, Bronstedin ja Lowry -teorian mukaan. Hänen nimensä tulee kreikkalaisesta sanasta Amfoteroi, mikä tarkoittaa "molemmat".
Monet metallit muodostavat amfoterosioksidit tai hydroksidit, mukaan lukien kupari, sinkki, tina, lyijy, alumiini ja beryllium. Näiden oksidien ominainen amfoteri riippuu kyseisen oksidin hapetustilasta. Artikkelin lopussa esimerkkejä näistä aineista sisältyy.

Metallioksidit, jotka voivat reagoida happojen ja emästen kanssa suolojen ja veden tuottamiseksi, tunnetaan amfoterosioksideina. Lyijy- ja sinkkioksidit ovat erittäin hyviä esimerkkejä muun muassa yhdisteistä.
[TOC]
Mitkä ovat amfoter?
Bronstedin ja Lowryn happo-emästeorian mukaan hapot ovat niitä aineita, jotka luovuttavat protonit, kun taas emäkset ovat ne, jotka hyväksyvät tai ottavat protonit.
Amprote -nimellä molekyylillä on reaktioita, joissa se hankkii protoneja, koska sillä on myös kyky lahjoittaa ne (vaikka se ei aina ole niin, kuten seuraavassa osassa nähdään).
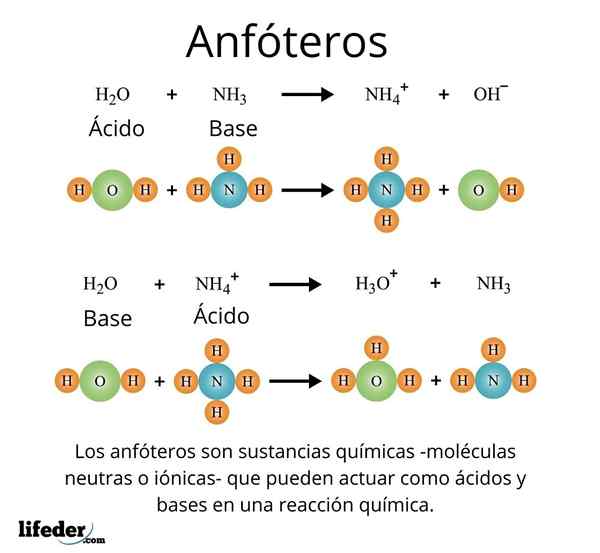
Tärkeä ja hyvin tunnustettu tapaus on yleinen liuotin, vesi (H₂O). Tämä aine reagoi helposti happojen kanssa, esimerkiksi reaktiossa suolahapon kanssa:
H2O + hcl → h3JOMPIKUMPI+ + Cl-
Mutta hänellä puolestaan ei myöskään ole ongelmia reagoivan pohjan kanssa, kuten ammoniakin tapauksessa:
H2O + NH3 → NH4 + vai niin-
Näillä esimerkeillä voidaan havaita, että vesi toimii täysin amfotaattina aineena.
Amfoottorityypit
Vaikka amfotoniset aineet voivat olla molekyylejä tai ioneja, on molekyylejä, jotka parhaiten osoittavat amfotoniset ominaisuudet ja auttavat tutkimaan tätä käyttäytymistä paremmin: amfrofroottiset aineet. Nämä ovat molekyylejä, jotka voivat erityisesti lahjoittaa tai hyväksyä protonin toimiakseen happona tai emäksinä.
Voi palvella sinua: Rodio: Historia, ominaisuudet, rakenne, käyttö, riskiOn selvennettävä, että kaikki amfoottiset aineet ovat amfoottisia, mutta kaikki amfoottorit eivät ole amfertisiä; On amfotoroja, joilla ei ole protoneja, mutta ne voivat käyttäytyä hapona tai emäksinä muilla tavoilla (kuten Lewisin teoria).
Amphiprtisten aineiden joukossa ovat vesi, aminohapot ja bikarbonaatti ja sulfaatti -ionit. Amfrofoottiset aineet puolestaan ovat myös alaluokkaisia kykynsä luovuttamisen tai protonien tuottamisen mukaan:
Protogeeniset tai amfipryeettiset happo -aineet
Ovat niillä, joilla on suurempi taipumus antaa protoni kuin hyväksyä yksi. Näistä ovat rikkihappoa (H2Sw4) ja etikkahappo (CHO3Cooh) muun muassa.
Perusprotofiiliset tai amfoottiset aineet
He ovat niitä, joille protonin hyväksyminen on yleisempiä kuin sen saaminen. Näistä aineista löydät ammoniakkia (NH3) ja etylendiamidi [c2H4(NH2-A2-.
Neutraalit aineet
Heillä on sama helppo tai kyky hyväksyä protoni kuin luopua siitä. Näiden joukossa on vettä (H2O) ja vähäiset alkoholit (-roh), lähinnä.
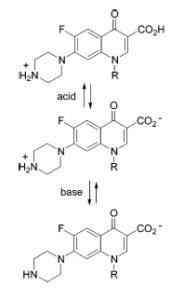 Quinolonien ampotero -luonne
Quinolonien ampotero -luonne Esimerkkejä amfotonisista aineista
 Amphotero -jännitys
Amphotero -jännitys Nyt olet jo kuvaillut amfotonisia aineita, on tarpeen merkitä esimerkkejä reaktioista, joissa nämä ominaisuudet esitetään.
Hiilihapon ioni esittelee amfertisen aineen emäksisen tapauksen; Silloin heidän reaktionsa esitetään, kun se toimii happona:
HCO3- + vai niin- → CO32- + H2JOMPIKUMPI
Seuraava reaktio tapahtuu, kun se toimii emäksenä:
HCO3- + H3JOMPIKUMPI+ → H2Yhteistyö3
On myös monia muita aineita. Näistä ovat seuraavat esimerkit:
Amfoterosoksidit
Sinkkioksidi, kuten jo mainittiin, on amfotero, mutta ei amfiprtistä ainetta. Seuraavaksi on osoitettu miksi.
Voi palvella sinua: Justus von LiebigKäyttäytyminen happona:
Zno + h2Sw4 → Znso4 + H2JOMPIKUMPI
Käyttäytyminen pohjana:
ZnO + 2NAOH + H2O → NA2[Zn (OH)4-
Lyijyoksidi (PBO), alumiini (Al2JOMPIKUMPI3) ja tinalla (SNO) on myös omat amfotoniset ominaisuudet:
Käyttäytyminen kuin hapot:
PBO + 2HCL → PBCL2 + H2JOMPIKUMPI
Siihen2JOMPIKUMPI3 + 6HCL → 2Alcl3 + 3H2JOMPIKUMPI
Sno + hcl ↔ sncl + h2JOMPIKUMPI
Ja emäksinä:
PBO + 2NAOH + H2O → NA2[PB (OH)4-
Siihen2JOMPIKUMPI3 + 2NAOH + 3H2O → 2NA [Al (OH)4-
Sno + 4naoh + h2Tai ↔ na4[Sn (OH)6-
Siellä on myös amfoterosioksideja gaulista, intialaisesta, skandiosta, titaanista, sironiumista, vanadista, kromista, raudasta, koboltista, kuparista, hopeasta, kultaisesta, saksalaisesta, antimonista, vismuthista ja Telurio.
Antfooterihydroksidit
Hydroksidit voivat olla myös amfotonisia ominaisuuksia, kuten alumiinihydroksidin ja berylliumin tapauksissa. Molemmat esimerkit havaitaan alla:
Alumiinihydroksidi happona:
Al (OH)3 + 3HCL → Alcl3 + 3H2JOMPIKUMPI
Alumiinihydroksidi pohjana:
Al (OH)3 + NaOH → Na [Al (OH)4-
Berylliumhydroksidi happona:
Ole (Voi)2 + 2HCl → Becl2 + H2JOMPIKUMPI
Beryllium -hydroksidi emäksenä:
Ole (Voi)2 + 2NAOH → NA2[Ole (OH)4-
Amfoterosten, amfiprtisten, amfoliittien ja apulaisten väliset erot
On tarpeen tietää, kuinka kunkin termin käsite voidaan erottaa, koska sen samankaltaisuus voi tulla hämmentäväksi.
On tiedossa, että amfotorot ovat aineita, jotka käyttäytyvät kuin hapot tai emäkset reaktiossa, joka tuottaa suolaa ja vettä. He voivat tehdä tämän protonin lahjoittamiseksi tai vangitsemiseksi tai yksinkertaisesti hyväksymällä elektronisen vääntömomentin (tai antamalla sen) Lewisin teorian mukaan.
Toisaalta amfoottiset aineet ovat niitä amfotereita, jotka toimivat happona tai emäksenä protonin luovuttamisen tai keräämisen kanssa, Bronsted-Lowryn lain mukaan. Kaikki amfoottiset aineet ovat amfoottisia.
Voi palvella sinua: bentsoiini: rakenne, ominaisuudet, käytöt ja riskitAmpoliitiset yhdisteet ovat amfotonisia molekyylejä, jotka ovat olemassa samanaikaisina ja joilla on dipoli -ioneja tietyissä pH: n fyaleissa. Niitä käytetään vaimennusagentteina puskuriliuoksissa.
Lopuksi, puristus liuottimet ovat niitä, joilla ei ole protoneja antaa ja jotka eivät myöskään voi hyväksyä niitä.
Viitteet
- Amfoteerinen. (2008). Wikipedia. Saatu.Wikipedia.org
- Anne Marie Helmestine, P. (2017). Mitä amfoteerinen tarkoittaa kemiassa?. Saatu Thidscosta.com
- Bicpuc. (2016). Amfoteeriset yhdisteet. Saatu medumista.com
- Kemikooli. (S.F.-A. Määritelmä amfoteerinen. Saatu Chemicoolista.com.

