Bentseenihistoria, rakenne, ominaisuudet, johdannaiset, käytöt

- 3448
- 610
- Mr. Clifford Kshlerin
Hän bentseeni Se on orgaaninen yhdiste, joka koostuu yhdestä yksinkertaisimmista aromaattisista hiilivedyistä. Sen kemiallinen kaava on c6H6, josta tiedetään, että hiilen ja vedyn välinen suhde on yhtä suuri kuin 1; eli jokaiselle hiilelle tähän on kytketty vety.
Vaikka sen fyysinen ulkonäkö on väritön neste, sitä löytyy luonnollisesti öljystä ja siitä johdettuista tuotteista. Sen haju on erittäin ominaista, koska se muistuttaa liiman, bitumin ja bensiinin seosta; Toisaalta se on haihtuva ja syttyvä neste.
 Kehittyminen bentseenillä. Lähde: AIR1404 [CC 4: llä.0 (https: // creativecommons.Org/lisenssit/by/4.0)]
Kehittyminen bentseenillä. Lähde: AIR1404 [CC 4: llä.0 (https: // creativecommons.Org/lisenssit/by/4.0)] Yläkuvassa esitetään säiliö tai pullo, jossa on bentseeniä, oletettavasti ei -analyyttistä puhtautta. Jos bentseenihöyryt paljastetaan välittömästi koko laboratoriossa. Tästä syystä tätä nestettä, jota käytetään yleisesti yksinkertaisena liuottimena, manipuloidaan kaasu -uuttokellon sisällä.
Ollessasi kaava C6H6, Yhdeksännentoista vuosisadan kemikaalit nostivat lukuisia mahdollisia rakenteita, jotka vastaavat mainittua osuutta C/H, yhtä suuri kuin 1. Ei vain tämä, mutta bentseenimolekyylillä oli oltava erityisiä linkkejä siten, että sen epätavallinen stabiilisuus voitaisiin selittää lisäysreaktioille; tyypillinen alkeenille ja politiikoille.
Se oli niin, että hänen linkkinsä edustivat arvoitusta tuon ajan kemikaaleille; Kunnes omaisuus nimeltään aromaattinen. Ennen kuin pidetään heksaasyklotrieenia (kolmella sidoksella c = c), bentseeni on paljon enemmän, ja se on toinen monista esimerkeistä kemian synergiasta.
Orgaanisessa kemiassa bentseeni on klassinen symboli, rakenteellinen perusta useille polylaromaattisille yhdisteille. Sen kuusikulmiosta johdannaisten sinfiinit saadaan aromaattisen elektrofiilisen substituution avulla; Rengas, jonka reunat rajoittuvat rakenteen, joka määrittelee uudet yhdisteet.
Itse asiassa sen johdannaiset ovat velkaa laaja teollisuuskäyttö niille, jotka tarvitsevat bentseeniä raaka -aineidensa joukossa. Tekstiililiiman ja kuitujen valmistelusta muoveihin, kumiin, pigmentteihin, lääkkeisiin ja räjähteisiin. Toisaalta bentseeniä löytyy luonnollisesti tulivuorista, metsäpaloista, bensiinistä ja savukkeiden savusta.
[TOC]
Historia
Löytö ja nimet
Hänen löytönsä juontaa juurensa vuoteen 1825, joka yleensä myönnettiin Michael Faradaylle, kun hän keräsi ja kokeilee valaistukseen käytetyn kaasun jäljellä olevan öljytuotteen kanssa. Tämä neste sisälsi osuuden c/h lähellä 1, minkä vuoksi se kutsui sitä "kaasutettuun vety".
Kemisti Auguste Laurent nimitti omituisen hiilivety 'feno', johdettu kreikkalaisesta sanasta 'Phaínein'Mikä tarkoittaa loistavaa (koska se saatiin kaasun polttamisen jälkeen). Tiedeyhteisö ei kuitenkaan hyväksynyt tätä nimeä ja vallitsi vain 'fenyyliksi', viitata bentseenistä johdettuun radikaaliin.
Yhdeksän vuotta myöhemmin bentsoiinikumista kemisti Eilhard Mitscherlich onnistui tuottamaan saman yhdisteen; Siksi oli toinen lähde samalla hiilivetylle, jonka hän kastoi "bentsina". He eivät kuitenkaan myöskään ottaneet asianmukaista nimeä olettaen, että se oli alkaloidi, kuten kiniini.
Siten he korvasivat nimen 'bencina' bentsolilla. Oli kuitenkin jälleen ristiriitoja ja eroja, koska termi 'bentsoli' sekoitti alkoholin hiilivety. Silloin syntyi nimi 'bentseeni', jota käytettiin ensin Ranskassa ja Englannissa.
Se voi palvella sinua: litiumkarbonaatti (LI2CO3): rakenne, ominaisuudet, käytötTeollisuustuotanto
Kumpikaan valaistuskaasu tai bentsoiini -kumi eivät olleet sopivia lähteitä bentseenin tuottamiseksi suuriin asteikkoihin. CHARLES MANSFIELD, joka työskenteli August Wilhelm von Hofmannin kanssa, saavutettiin vuonna 1845 eristämään bentseeni (kaksikymmentä vuotta sen löytön jälkeen) Hulla TAR: sta, koksin tuotannon sivutuotteesta,.
Siten bentseenin teollisuustuotanto alkoi hullatarasta. Bentseenin saatavuus massiivisissa määrissä, helpotti sen kemiallisten ominaisuuksien tutkimusta ja antoi sen yhdistää sen muihin samanlaisten reaktiivisuuksien yhdisteisiin. Elokuu Wilhelm von Hofmann loi sanan 'aromaattinen' bentseenille ja siihen liittyville yhdisteille.
Historialliset rakenteet
August Kekulén unelma
Friedrich August Kekulé myönnetään bentseenin kuusikulmainen ja syklinen rakenne noin vuonna 1865, mikä johtuu outosta unelmasta Uroborosin kanssa, käärme, joka puree omaa häntään piirtämällä ympyrää. Siten hän uskoi, että bentseeniä voidaan pitää kuusikulmainen rengas ja muut kemikaalit nostivat mahdollisia rakenteita, jotka on esitetty alla:
 Bentseenirengasrakenteet, jotka on ehdotettu koko historian ajan. Lähde: Jü [julkinen verkkotunnus]
Bentseenirengasrakenteet, jotka on ehdotettu koko historian ajan. Lähde: Jü [julkinen verkkotunnus] Jotkut ylemmistä rakenteista voisivat perustella bentseenin stabiilisuuden.
Kirja, renkaat ja prisma
Huomaa, että kolmas rakenne ei ole edes rengas, vaan kolmionmuotoinen prisma, jonka Albert Ladenburg ehdotti vuonna 1869; Vasemmalla puolellaan Sir James Dewarin ehdotti avoin kirja -muotoinen; Ja oikealla puolellaan, joka on kaikkien renkaan keskustaan suunnattu hydrogeenit, Henry Edward Armstrong ehdotti vuonna 1887.
Ensimmäinen rakenne, jonka Adolf Karl Ludwig Claus ehdotti vuonna 1867, on myös melko erikoinen, koska C-C-linkit ylitetään. Ja viimeinen oli Kekulén "Serpentine" -rengas, haaveili vuonna 1865.
Mikä oli "voittaja"? Viides rakenne (vasemmalta oikealle), jonka Johannes Thiele ehdotti vuonna 1899.
Tässä resonanssihybridiä tarkasteltiin ensimmäistä kertaa, jossa yhdistyivät kaksi Kekulé -rakennetta (käänsi ensimmäisen renkaan oikealla tavalla tarkkailemaan sitä) ja selitti poikkeuksellisen elektronien siirtämisen ja sen kanssa siihen asti, kunnes epätavallinen stabiilisuus bentseeni.
Bentseenirakenne
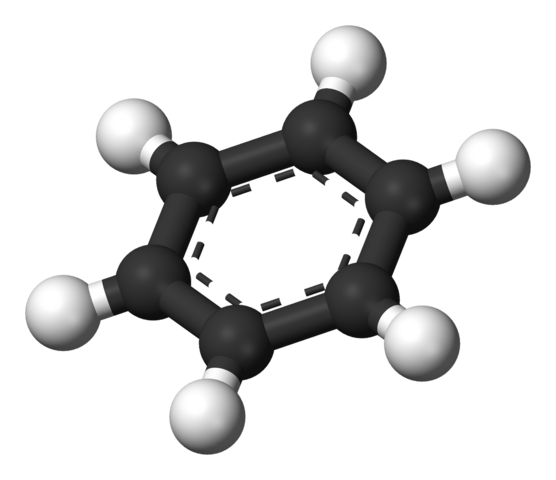 Bentseeni aromaattinen rengas. Lähde: Benjah-BMM27 [julkinen alue]
Bentseeni aromaattinen rengas. Lähde: Benjah-BMM27 [julkinen alue] Thielen ehdottama rakenne on osoitettu pallo- ja baarimallilla.
Bentseenimolekyyli on tasainen, vetyatomien osoituksena renkaan sivuilta. Kaikilla hiiliatomeilla on SP -hybridisaatio2, Kiertoradalla p Käytettävissä aromaattisen järjestelmän perustamiseksi, jossa kuusi elektronia muuttavat.
Nämä Carbonos SP2 Ne ovat enemmän elektronegatiivisia kuin vetyjä, ja siksi ensimmäinen poista elektroninen tiheys jälkimmäiseen (CSP2Δ--HΔ+-A. Tämän seurauksena renkaan keskustassa on suurempi elektronien pitoisuus kuin sen sivuilla.
Tarkemmin sanottuna aromaattinen järjestelmä voidaan edustaa pilvinä tai elektronisena tyynynä, jota laajentaa kuusikulmaisen renkaan molemmat puolet; ja keskellä, sivuilla tai reunoilla, elektroninen puute, jonka hydrogenit ovat positiivisen osittaisen kuormituksen kanssa.
Tämän sähkövarausten jakautumisen ansiosta bentseenimolekyylit voivat olla vuorovaikutuksessa toistensa kanssa dipoli-dipolovoimien kautta; Atomit hΔ+ He tuntevat vetovoiman naapurirenkaan aromaattiseen keskukseen (tämän alapuolella on edustettua).
Samoin aromaattiset keskukset voidaan pinota toistensa päälle välittömien dipolien induktion suosimiseksi.
Voi palvella sinua: AlotropiaResonanssi
 Bentseenin rakenteet ja resonanssihybridi. Lähde: Wikipedia Edgar181.
Bentseenin rakenteet ja resonanssihybridi. Lähde: Wikipedia Edgar181. Kaksi Kekulé -rakennetta esitetään kuvan yläosassa, ja niiden alla resonanssihybridi. Kun nämä kaksi rakennetta tapahtuvat uudestaan ja samaan aikaan, hybridi esitetään keskellä vedetyllä ympyrällä (samanlainen kuin "kuusikulmainen munkki").
Hybridi -ympyrä on tärkeä, koska se osoittaa bentseenin aromaattisen luonteen (ja monien muiden yhdisteiden). Lisäksi hän huomauttaa, että linkit eivät ole niin kauan kuin C-C, eikä niin lyhyitä kuin C = C; Mutta niiden pituus on molempien päiden välillä. Siten bentseeniä ei pidetä poleheenina.
Yllä oleva on osoitettu mittaamalla bentseenin C-C-linkkien (139 PM) pituudet, jotka ovat hiukan pitkänomaisia kuin C-H-sidokset (109 PM).
Kiteet
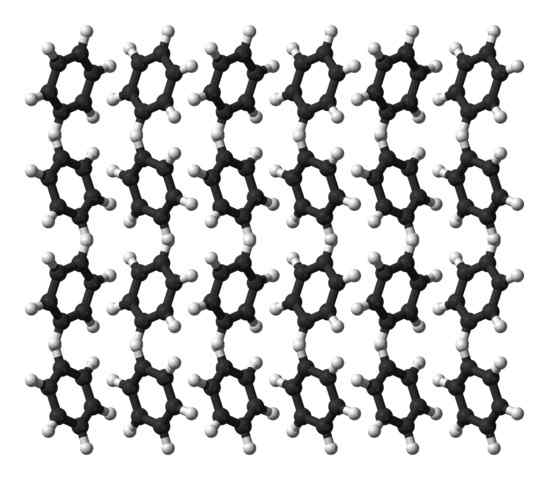 Bentseeniortorrominen kiderakenne. Lähde: Ben Mills [julkinen alue]
Bentseeniortorrominen kiderakenne. Lähde: Ben Mills [julkinen alue] Bentseeni on neste huoneenlämpötilassa. Sen molekyylien väliset voimat tekevät siitä huolimatta, että sillä on niin voimakas dipolimomentti, se voi pitää molekyylit yhdessä nesteessä, joka kiehuu 80 ° C: ssa. Kun lämpötila laskee alle 5ºC, bentseeni alkaa jäätyä: ja siten niiden vastaavat kiteet saadaan.
Bentseenirenkaat voivat omaksua rakenteelliset kuviot määriteltyinä. Heidän dipolit tekevät heistä "kallistuneita" vasemmalle tai oikealle muodostaen joukkoja, jotka kykenevät lisääntymään ortomissa ortorromisella solulla. Siten bentseenikiteitä ovat ortorromisia.
Huomaa ylemmässä kuvassa, että kun renkaat ovat taipuvaisia suosimaan H: n välistä vuorovaikutustaΔ+ ja aromaattiset keskukset, mainitut aiemmissa alaosissa.
Ominaisuudet
Molekyylimassa
78 114 g/mol.
Fyysinen ulkonäkö
Väritön neste, jonka haju on samanlainen kuin bensiini.
Kiehumispiste
80ºC.
Sulamispiste
5,5ºC.
sytytyspiste
-11ºC (suljettu kuppi).
Itsekiinnityslämpötila
497,78ºC.
Tiheys
0,8765 g/ml 20ºC: n lämpötilassa.
Liukoisuus
Litra kiehuvaa vettä voi tuskin liuottaa 3,94 g bentseeniä. Hänen apolaarinen luonteensa tekee siitä käytännössä sekoittumattoman vedellä. Se on kuitenkin sekoittumassa muiden liuottimien, kuten etanolin, eetterien, asetonin, öljyjen, kloroformin, hiilitetrakloridin jne.
Höyryn tiheys
2.8 Airisuhteessa (eli melkein kolme kertaa enemmän).
Höyrynpaine
94,8 mm Hg 25 ° C: ssa.
Palamislämpö
-3267,6 kJ/mol (nestemäiselle bentseenille).
Höyrystyslämpö
33,83 kJ/mol.
Pintajännitys
28,22 mn/m 25ºC.
Taitekerroin
1,5011 - 20ºC.
Johdannaiset

Bentseenihydroina voidaan korvata muilla ryhmillä tai atomilla. Voi olla yksi tai useampi substituutio, mikä lisää substituutioastetta kuudesta alkuperäisestä hydrogeista asti.
Esimerkiksi Benceno pH-H: na, jossa H on mikä tahansa kuudesta hydrogensista. Muistaen, että renkaan keskustassa on suurempi elektroninen tiheys, houkuttelee elektrofiilejä, jotka hyökkäävät renkaaseen H: n korvaamiseksi reaktiossa, jota kutsutaan aromaattiseksi elektrofiiliseksi substituutioksi (SEAR).
Jos tämä H korvataan OH: lla, pH-OH, fenolilla on; CHO: n korvaaminen3, PH-CH-CH3, Tolueeni; Jos se on NH2, PH-NH2, aniliini; Tai jos se on Cho2CH3, PH-CH-CH2CH3, Etyylibentseeni.
Johdannaiset voivat olla samoja tai myrkyllisempiä kuin bentseeni tai päinvastoin, niin monimutkaisia.
Voi palvella sinua: kalsiumkarbidi (CAC2): rakenne, ominaisuudet, hankkiminen, käyttöSovellukset
Se on hyvä liuotin monille monille yhdisteille, joita esiintyy esimerkiksi maalauksissa, lakat, liimat ja pinnoitteet.
Se voi myös liuottaa öljyjä, rasvoja tai vahaa, joten sitä on käytetty Essence -uuttoliuottimena. Ludwig Roselius käytti tätä ominaisuutta vuonna 1903 kahvin kofeiinin, joka on jo käytössään bentseenin myrkyllisyyden vuoksi. Samoin sitä käytettiin aikaisemmin metallien polttamiseen.
Yhdessä klassikossa se ei toimi liuottimena, vaan lisäaineena: lisää bensiinin oktaania, korvaa lyijyn tähän tarkoitukseen.
Bentseenijohdannaisilla voi olla erilaisia käyttötarkoituksia; Jotkut toimivat torjunta -aineina, voiteluaineina, pesuaineina, muovina, räjähteinä, hajuvesillä, väriaineilla, liimalla, lääkkeillä jne. Jos rakenteessaan on bentseenirengas, on melko todennäköistä, että sen synteesi on jättänyt bentseenin.
Sen tärkeimpien johdannaisten joukossa ovat: cumeno, ksyleeni, aniliini, fenoli (fenolihartsien synteesiä varten), bentsoehapon (säilöntäaine), sykloheksanin (nilonin synteesiä varten), nitrobentseeni, resortsinoli ja etyylibentseeni.
Nimikkeistö
Bentseenijohdannaisten nimikkeistö vaihtelee korvausasteen, mitkä ovat substituenttiryhmät ja niiden suhteelliset asemat. Siten bentseeni voi kärsiä apina-, di-, tri-, tetra jne., Korvaus
Kun kaksi ryhmää on kytketty vierekkäisiin hiiliin, käytetään 'orto' -kirkkoa; Jos niiden erottaminen on hiili, 'tavoite'; Ja jos hiilit ovat vastakkaisissa asennoissa, '.
Alemmassa kuvissa esitetään esimerkkejä bentseenijohdannaisista vastaavilla nimillään, joita nimeä hallitsee IUPAC. Niihin liittyy myös yleisiä tai perinteisiä nimiä.
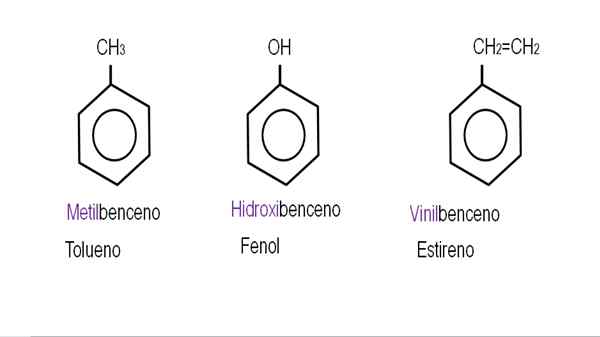 Bentseeni. Lähde: Gabriel Bolívar.
Bentseeni. Lähde: Gabriel Bolívar. 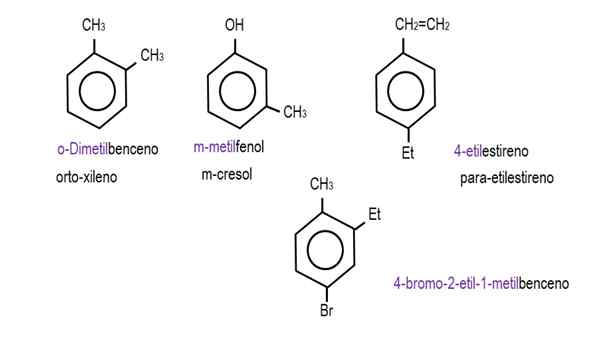 Muut bentseenijohdannaiset. Lähde: Gabriel Bolívar.
Muut bentseenijohdannaiset. Lähde: Gabriel Bolívar. Huomaa, että trisustuned -bentseenissä orto -indikaattorit, sillä ja tavoite he lakkaavat olemasta hyödyllisiä.
Myrkyllisyys
Bentseeni on yhdiste, jota on manipuloitava huolellisesti. Sen erityisen hajun vuoksi välittömät kielteiset vaikutukset voivat olla tukehtumista, huimausta, päänsärkyä, vapinaa, uneliaisuutta, pahoinvointia ja jopa kuolemaa (ennen korkeaa altistumista). Jos jo mainittua, vatsakivut ja kouristukset voivat aiheuttaa akuuttia.
Lisäksi pitkän aikavälin vaikutukset jatkuvalle altistumiselle tälle nesteelle ovat syöpää aiheuttavia; Lisää mahdollisuuksia, että henkilö kärsii jonkin tyyppisestä syövästä, erityisesti verestä: leukemia.
Veressä se voi vähentää punasolujen pitoisuutta aiheuttaen anemiaa ja vaikuttaa myös luuytimeen ja maksaan, missä keho rinnastaa sen vielä myrkyllisempien bentseenijohdannaisten tuottamiseksi; Esimerkiksi hydroksiikinoni. Se kerääntyy myös munuaisissa, sydämessä, keuhkoissa ja aivoissa.
Viitteet
- Morrison, r.T. Ja Boyd, R. N. (1987). Orgaaninen kemia. (5. painos). Addison-Wesley Iberoamericana.
- Carey, f. -Lla. (2008). Orgaaninen kemia. (6. painos). McGraw-Hill, Intermerica, toimittajat S.-Lla.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. Amiini. (10. painos.-A. Wiley Plus.
- Kansallinen bioteknologiatietojen keskus. (2019). Bentseeni. Pubchem -tietokanta. CID = 241, palautettu: Pubchem.NCBI.Nlm.NIH.Hallitus
- Wikipedia. (2019). Bentseeni. Haettu: vuonna.Wikipedia.org
- Garcia Nissa. (2019). Mikä on bentseeni? - Käyttö, rakenne ja kaava. Opiskelu. Toipunut: Opiskelu.com
- Tautien torjunta- ja ehkäisykeskukset. (4. huhtikuuta 2018). Fakia bentseenistä. Toipunut: hätätilanne.CDC.Hallitus
- Maailman terveysjärjestö. (2010). Altistuminen bentseenille: Suuri kansanterveysongelmat. [PDF]. Toipunut: kuka.int
- Fernández Germán. (S.F.-A. Bentseenimominaisuuden ongelmat. Orgaaninen kemia. Toipunut: Chemicicaorganica.org
- « Kosmopolitismin käsite, alkuperä, Kantin visio, yhteiskunta
- Turistien maantieteellinen opinto, alkuperä, aputieteet »

