Butanonirakenne, ominaisuudet ja käyttötarkoitukset
- 4104
- 966
- Mr. Clifford Kshlerin
Se Butanoni Se on orgaaninen yhdiste, erityisesti ketoni, jonka kemiallinen kaava on CHO3CH2Kokki3. Sen ulkonäkö on väritön neste, jota käytetään pohjimmiltaan liuottimena. Sillä on samanlainen kuin asetoniominaisuudet, mutta kiehuu korkeammalla lämpötilassa ja haihtuu hitaammin.
Sitä tuotetaan 2-butanolin (kiraalinen yhdiste) katalyyttinen dehydraus. Se on kuitenkin luonnollisessa tilassa joidenkin hedelmien koostumuksessa. Se on osa ajoneuvojen pakoputkien säteilyä, ja se on osa tupakansavua.
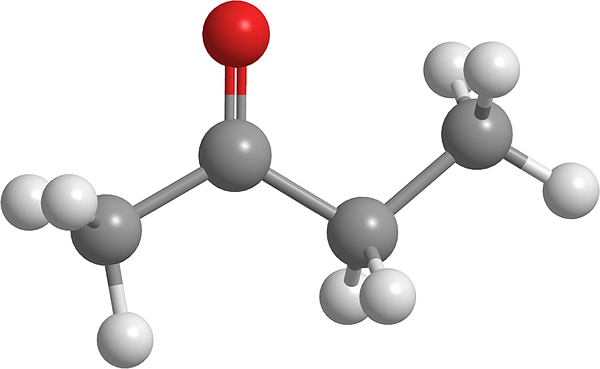
 Butanonimolekyyli. Lähde: Pixabay.
Butanonimolekyyli. Lähde: Pixabay. Se on asetonin jälkeen yksinkertaisin tästä orgaanisten yhdisteiden perheestä. Butnononi aiheuttaa silmien ja nenän ärsytystä. Epätavallisen suurella annoksella se voi aiheuttaa keuhkojen limakalvon ärsytystä. Toisaalta tätä nestettä pidetään huumausaineiden edeltäjänä.
Butanonella on suuri liukoisuus veteen; Mutta se on myös erittäin liukoinen orgaanisiin liuottimiin, kuten etanoliin, eetteriin, asetoniin, bentseeniin ja kloroformiin. Tämä voitaisiin selittää, koska sen P -log (0,29) -arvo oktaani/vesi -osiokertoimelle on alhainen.
[TOC]
Butanonirakenne
Yläkuvassa butanonimolekyyli on esitetty palloilla ja baarimallilla. Karbonyyliryhmän happiatomi (punainen pallo) voidaan nähdä toisessa hiilessä. Tämä ryhmä, C = O, on vastuussa pysyvän dipolimomentin antamisesta molekyyliin.
Butanoni, rakenteellisesti näkymä, ei ole muuta kuin asetonia, johon metyleeniryhmä on lisätty, CH2. Koska dipolimomentti on enemmän hiilejä, on pienempi verrattuna asetoniin; Mutta sen suurin molekyylimassa aiheuttaa sen kiehuvan korkeammassa lämpötilassa.
Tältä molekyylistä, kuten muilta ketoneista, puuttuu mahdollisuus muodostaa vety silloja; Ja siksi heidän dipoli-dipolo-vuorovaikutuksensa eivät ole niin vahvoja.
Voi palvella sinua: emulgoija: emulsioprosessi, molekyyliset näkökohdat, sovelluksetSiksi se on haihtuva neste. Kun lämpötila laskee (-86,6 ° C), sen heikko dipolit ovat ne, jotka ohjaavat niiden molekyylejä kristallin muodostamiseksi. Tämän lisäksi voidaan myös kommentoida, että butanoni on rakenteellisesti epäsymmetrinen.
Ominaisuudet
Molekyylikaava
C4H8Tai ch3Kokki2CH3
Nimeä
- Butanoni.
- 2-butanoni.
- Butan -2 -ona.
- Metyyli -etiil cetona.
Moolimassa
72 107 g/mol.
Fyysinen kuvaus
Väritön neste.
Haju
Tuoksuva rahapaja, kohtalaisen vahva.
Kiehumispiste
79,59 ºC 760 mmHg.
Sulamispiste
-86.6 ºC.
sytytyspiste
-9 ºC (suljettu kuppi).
Vesiliukoisuus
29 g /100 ml 20 ° C: ssa. Vaikka sen dipolimomentti on pienempi kuin asetonin, se voi silti olla vuorovaikutuksessa erinomaisessa määrin vesimolekyylien kanssa. Heiltä vastaanottaa vety sillat: (CH3) (CH2CH3) C = o-hah. Tämän vuoksi on hyvin liukoinen veteen.
Liukoisuus orgaanisiin liuottimiin
Liukoinen bentseeniin, alkoholiin ja eetteriin; sekoittuu öljyjen, etanolin, eetterin, asetonin, bentseenin ja kloroformin kanssa. Huomaa, että butanoni on liukoinen monenlaisiin liuottimiin.
Tiheys
0,7997 g/cm3 25 ºC: lla.
Höyryn tiheys
2,41 (suhteessa veteen = 1).
Höyrynpaine
90,6 mmHg 25 ºC: n lämpötilassa.
Oktanoli/vesijakokerroin
Log p = 0,29
Itsekiinnityslämpötila
505 ºC.
Hajoaminen
Se hajoaa fotokemiallisten prosessien avulla hapettumalla vapaan hydroksyyliradikaalin avulla. Hajoamiseen lämmitettyä hehtaarin savua.
Goo
0,40 CPOISE 25 ºC: lla.
Palamislämpö
2.444,1 kJ/mol 25 ° C: ssa.
Höyrystyslämpö
31.30 kJ/mol kiehumispisteessä; ja 34,79 kJ/mol 25 ° C: ssa.
Voi palvella sinua: Yleinen kaasulakiPintajännitys
23,97 mn/m 25 ºC.
Ionisaatiopotentiaali
0,54 eV.
Hajukynnys
Matala haju: 0,735 mg/m3.
Korkea haju: 147,5 mg/m3.
Taitekerroin
1 788 - 20 ºC.
Dissosiaatiovakio
Pka = 14,70.
Vakaus
Vakaa, mutta erittäin syttyvä. Yhteensopimattomia hapettavien aineiden, emäksen ja voimakkaiden pelkistävien aineiden kanssa. Kosteutta tulisi välttää.
Sovellukset
Liuotin
Butaanonia käytetään liuottimena pintapäällysteiden kehittämisessä, savuttoman pölyn valmistuksessa, värillisten hartsien kehittämisessä ja voiteluaineiden tuottaman rasvan kertymisen eliminoinnissa.
Lisäksi sitä käytetään:
- Tekonahka.
- Gomas.
- Lacas.
- Lakkaus.
- Liima.
- Liuottimet.
- Maalata.
- Liimat.
- Muovisementti.
- Tiivisteaineet.
- Magneettiset nauhat.
- Läpinäkyvä paperi.
- Tulostusmusteet.
- Kosmetiikka ja lääketuotteet.
Sitä käytetään myös liuottimena metallipintojen, elektronisten laitteiden puhdistusaineiden ja rasvan uuttamisen määrittelemiseen. Se palvelee kovaa puun uuttamista ja kasviöljyä.
Se on inertti ainesosa torjunta -aineiden kehittämisessä sekä asetaatin ja selluloosan nitraatin valmistuksessa.
Sitä käytetään uuttoliuottimena elintarvikkeiden jalostuksessa ja elintarvikkeiden ainesosissa; Esimerkiksi rasvojen ja öljyjen fraktioinnissa, samoin kuin kahvin kofeiinitussa prosessissa. Sitä käytetään myös liuottimena valkoisissa laudoilla käytetyissä markkereissa.
Reagenssi
- Butanonea käytetään vesiliukoisena valokuvaimaitoksena.
- Se tiivistää formaldehydin kanssa isopropenil -ketonin tuottamiseksi.
- Koe Autokoodenssi etyyliamylo Cetonan tuotannosta.
- Reagoi sitrraalin kanssa hajuvesien komponenttien, kuten metyylipseudoionin, saamiseksi.
Voi palvella sinua: Reaktiolämpö- Se puuttuu katalysaattorina hydrassiinin tuotannossa.
- Lisäksi se on edeltäjä metyylietyylisetona -peroksidille, joka on katalyytti joillekin polymerointireaktioille.
Muovisementti
Butanonella on levitys muovihitsaineena, ja sitä käytetään polystyreenimittakaavamallien kokoonpanossa. Butnononi liuottaa polystyreeniä, jolloin reunat voivat liittyä, kun uusi polymerointi tapahtuu. Tämä käyttäytyminen on sementtiä eikä liimaa.
Muut käyttötarkoitukset
Butanonea käytetään bakteerien itiöiden sterilointinä leikkausvälineissä, neuloissa, ihohenkilöstöä ja hammaslääketieteellisiä instrumentteja.
Sitä käytetään ruoan aromiaineena erittäin alhaisissa pitoisuuksissa; Esimerkiksi alkoholijuomissa pitoisuus on 20 ppm; leivotuissa tuotteissa, 12,7 ppm; Lihat ovat noin 26,5 ppm; pureskelukumi, 0,63 ppm; ja rasvoissa ja öljyissä 1,0 ppm.
Ja lopuksi, butanonia käytetään hemoproteiiniryhmän apoproteiinin erottamisessa hemoproteiineissa.
Viitteet
- Morrison, r. T. ja Boyd, R, N. (1987). Orgaaninen kemia. 5ta Painos. Toimituksellinen Addison-Wesley Inter-American.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. Amiini. (10thPainos.-A. Wiley Plus.
- Kansallinen bioteknologiatietojen keskus. (2019). Metyylietyyliketoni -pubchem -tietokanta. CID = 6569. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Wikipedia. (2019). Butanoni. Haettu: vuonna.Wikipedia.org
- Kuninkaallinen kemian yhdistys. (2015). Butanoni. Chemspider. Toipunut: Chemspider.com
- Arlem Cheprasov. (2019). Mikä on butaani? Kaava ja käyttö. Opiskelu. Toipunut: Opiskelu.com
- Ben Verve. (17. toukokuuta 2017). Butanoni. Kemiamaailma. Toipunut: ChemistryWorld.com

