Alumiinikarbonaattirakenne, ominaisuudet, käytöt
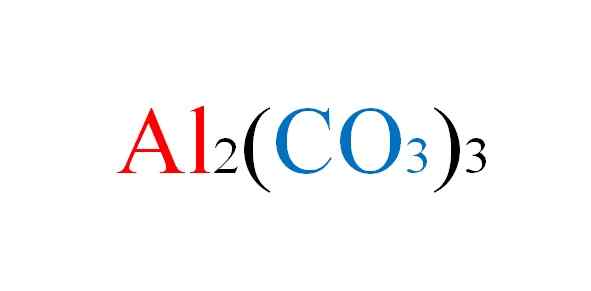
- 932
- 12
- Joshua Emmerich
Hän Alumiinikarbonaatti Se on epäorgaaninen suola, jonka kemiallinen kaava on2(Yhteistyö3-A3. Se on käytännössä olematon metallikarbonaatti, kun otetaan huomioon sen korkea epävakaus normaaleissa olosuhteissa.
Sen epävakauden syistä voimme mainita ionien väliset heikot sähköstaattiset vuorovaikutukset3+ ja yhteistyökumppani32-, jonka teoriassa tulisi olla erittäin vahva heidän kuormansa suuruuksille.
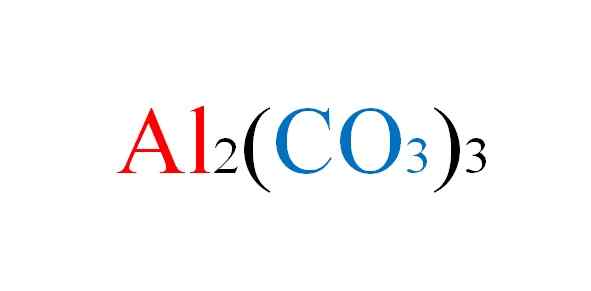 Alumiinikarbonaattikaava. Lähde: Gabriel Bolívar.
Alumiinikarbonaattikaava. Lähde: Gabriel Bolívar. Suola on paperilla haittoja, kun niiden reaktioiden kemialliset yhtälöt on kirjoitettu; Mutta käytännössä se on sitä vastaan.
Huolimatta sanottuna alumiinikarbonaattia voi tapahtua muiden ionien seurassa, kuten Dawsonite Mineralissa. On myös johdannainen, jossa se on vuorovaikutuksessa vesipitoisen ammoniakin kanssa. Muista sitä pidetään seoksena Al (OH) välillä3 ja h2Yhteistyö3; joka on yhtä suuri kuin poreileva liuos, jolla on valkoinen sakka.
Tällä seoksella on lääkinnällinen käyttö. AL: n puhtaalle, eristettävälle ja manipuloitavalle suolalle2(Yhteistyö3-A3, Sinua ei tunneta mahdollisia sovelluksia; Ainakin ei alhaiset valtavat paineet tai äärimmäiset olosuhteet.
[TOC]
Alumiinikarbonaattirakenne
Tämän suolan kiteinen rakenne ei ole tiedossa, koska se on niin epävakaa, että sitä ei ole pystynyt karakterisoimaan. Sen kaavasta2(Yhteistyö3-A3, On kuitenkin tiedossa, että ionien osuus3+ ja yhteistyökumppani32- Se on 2: 3; toisin sanoen jokaisesta kahdesta katiosta2+ On oltava kolme anionia32- vuorovaikutuksessa heidän kanssaan.
Ongelmana on, että molemmat ionit ovat hyvin epätasa -arvoisia niiden koon suhteen; AL3+ Se on hyvin pieni, kun taas CO32- Se on tilaa vievä. Tämä ero itsessään vaikuttaa jo kiteisen verkon retikulaariseen stabiilisuuteen, jonka ionit olisivat vuorovaikutuksessa "hankalasti", jos tämä suola -tilassa on eristetty suola.
Se voi palvella sinua: Avogadro -numero: historia, yksiköt, miten se lasketaan, käyttääTämän näkökohdan lisäksi Al3+ Se on erittäin polarisoiva kationi, ominaisuus, joka muodostaa CO: n elektronisen pilven32-. Vaikuttaa siltä, että hän halusi pakottaa hänet yhdistämään kovalenttisesti, vaikka anion ei voi tehdä niin.
Näin ollen ioniset vuorovaikutukset AL: n välillä3+ ja yhteistyökumppani32- He pyrkivät kovalenssiin; Toinen tekijä, joka lisää AL: n epävakautta2(Yhteistyö3-A3.
Hydroksidikarbonaatti alumiiniammonium
Kaoottinen suhde AL: n välillä3+ ja yhteistyökumppani32- Se pehmenee ulkonäöltään, kun lasissa on muita ioneja; kuten NH4+ ja oh-, ammoniakkiliuoksesta. Tämä ionikvartetto,3+, Yhteistyö32-, Nh4+ ja oh-, He onnistuvat määrittelemään vakaat kiteet, jopa kykenevät omaksumaan erilaisia morfologioita.
Toinen tämän samanlainen esimerkki havaitaan Dawsonite Mineralissa ja sen ortorromisissa kiteissä, Naalco3(VAI NIIN)2, Missä na+ Vaihda NH4+. Näissä suoloissa niiden ioniset sidokset ovat riittävän vahvoja, joten vesi ei edistä CO: n vapautumista2; tai ainakaan ei äkillisesti.
Vaikka NH4Al (OH)2Yhteistyö3 (AACC, sen sigles englanniksi) eikä Naalco3(VAI NIIN)2 Ne edustavat alumiinikarbonaattia, niitä voidaan pitää samanlaisina johdannaisina.
Ominaisuudet
Moolimassa
233,98 g/mol.
Epävakaus
Edellisessä osassa se selitettiin molekyylin näkökulmasta miksi Al2(Yhteistyö3-A3 Se on epävakaa. Mutta mitä muutosta se kärsii? Sinun on harkittava kahta tilannetta: yksi kuiva ja toinen "märkä".
Kuiva
Kuivassa tilanteessa Anion Co32- CO on päinvastainen2 Seuraavan hajoamisen kautta:
Siihen2(Yhteistyö3-A3 => Al2JOMPIKUMPI3 + 3CO2
Se voi palvella sinua: kalsiumfosfaatti (CA3 (PO4) 2)Mikä on järkevää, jos se syntetisoidaan alumiinioksidissa suuriin CO -paineisiin2; eli käänteinen reaktio:
Siihen2JOMPIKUMPI3 + 3CO2 => Al2(Yhteistyö3-A3
Siksi AL: n hajoamisen välttämiseksi2(Yhteistyö3-A3 Sinun on lähetettävä suola suuriin paineisiin (käyttämällä n2, Esimerkiksi). Tällä tavalla CO: n muodostuminen2 ei olisi termodynaamisesti suosittu.
Märkä
Märässä tilanteessa, CO32- Se kärsii hydrolyysistä, joka tuottaa pieniä määriä OH-; Mutta tarpeeksi alumiinihydroksidia saostamaan, kohdassa (OH)3-
Yhteistyö32- + H2Tai HCO3- + vai niin-
Siihen3+ + 3OH- Al (OH)3
Ja toisaalta Al3+ Se on myös hydrolysoitu:
Siihen3+ + H2Tai (OH)22+ + H+
Vaikka se todella kosteutetaan3+ Muodostaa kompleksi (H2JOMPIKUMPI)63+, joka on hydrolysoitu antamaan [H2JOMPIKUMPI)5Vai niin]2+ ja h3JOMPIKUMPI+. Sitten h3Tai (tai h+) Protona CO: lle32- h: lle2Yhteistyö3, joka hajoaa yhteistyöhön2 ja h2JOMPIKUMPI:
Yhteistyö32- + 2H+ => H2Yhteistyö3
H2Yhteistyö3 Yhteistyö2 + H2JOMPIKUMPI
Huomaa, että lopulta Al3+ Se käyttäytyy kuin happo (vapauta H+) ja pohja (vapauta OH- Al (OH) liukoisuuden tasapainossa (OH)3) Eli se osoittaa amfoterismia.
Fyysinen
Jotta voitaisiin eristää itsensä, tämä suola on todennäköisesti valkoinen, kuten monet muutkin alumiinisuolat. Myös AL: n ionisten radioiden välisen eron vuoksi3+ ja yhteistyökumppani32-, Varmasti sillä olisi erittäin alhaiset sulamis- tai kiehumispisteet verrattuna muihin ioniyhdisteisiin.
Se voi palvella sinua: Benchilo: Bentsyylihydrogeenit, karbokaatiot, bentsyyliradikaalitJa liukoisuuden suhteen se olisi äärettömän liukoinen veteen. Lisäksi se olisi hygroskooppinen ja herkullinen kiinteä. Nämä ovat kuitenkin vain oletuksia. Muut ominaisuudet olisi arvioitava laskentamalleilla, joihin kohdistuu korkeita paineita.
Sovellukset
Alumiinikarbonaatista tunnetut sovellukset ovat lääketieteellisiä. Sitä käytettiin pehmeänä supistavana ja lääkkeenä tulehduksen ja mahahaavan hoitamiseksi. Sitä on käytetty myös estämään virtsalaskelmien muodostuminen ihmisillä.
Sitä on käytetty fosfaatin kehon pitoisuuden lisääntymisen hallintaan ja myös mahalaukun happamuusoireiden, happojen ruoansulatushäiriöiden ja mahahaavojen hoitamiseen.
Viitteet
- Xuehui l., Zhe t., Yongming c., Ruiyu Z. & Chenguang l. (2012). Ammoniumalumiinikarbonaattihydroksidi (AACH) -nanoplatelat ja nanokuitujen pH-ohjatut morfologiat hydroterminen synteesi. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Ammoniumin alumiini -karbonaattihydroksidi NH4AL (OH) 2CO3 vaihtoehtoisena reitin alumiinin valmistukseen:. Powder Technology, 320, 565-573, doi: 10.1016/j.POWEC.2017.07.0080
- Kansallinen bioteknologiatietojen keskus. (2019). Alumiinikarbonaatti. Pubchem -tietokanta., CID = 1035396. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Wikipedia. (2019). Alumiinikarbonaatti. Haettu: vuonna.Wikipedia.org
- Alumiinisulfaatti. (2019). Alumiinikarbonaatti. Toipunut: Alumiinisulfaatti.netto

