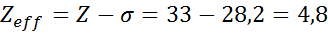Tehokas ydinkuorma
- 3231
- 673
- Louis Moen
Mikä on tehokas ydinkuorma?
Se tehokas ydinkuorma (edustettuna zEff Ja joissain tapauksissa z*) Se on netto ydinkuorma, jonka elektroni kokee, kun se on polyhelektronisessa atomisessa (ts. Siinä on useampi kuin yksi elektroni).
Tarkemmin sanottuna sähkövaraus olisi hypoteettisen atomin ydin, joka kykenee houkuttelemaan ainoan elektroninsa samalla voimalla, jolla todellisen atomin ydin houkuttelee samaa elektronia kaikkien muiden elektronien läsnäollessa.
Se on korjattu ydinkuorma, joka ottaa huomioon muiden elektronien läsnäolon vaikutuksen polylektroniseen atomiin. Tämä vähentynyt kuorma selittää, miksi polyelektronisen atomin uloimmat elektronit ovat heikommin kytkettynä ytimeen kuin sisäiset elektronit.
Tehokas ydinkuorma on erittäin tärkeä käsite kemiassa, koska se antaa meille mahdollisuuden ymmärtää monien ominaisuuksien, kuten atomissäde, ionisäde, elektronegatiivisuus, ionisaatioenergiat ja paljon muuta, jaksollista taipumusta.
Miksi tehokas ydinkuorma on olemassa?
Tehokas ydinkuorma syntyy kahdesta ilmiöstä:
- Elektronien suojausvaikutus polyelektronisiin atomiin.
- Sähköstaattinen torjuminen elektronien keskuudessa, koska jokaisella on sama sähkövaraus.
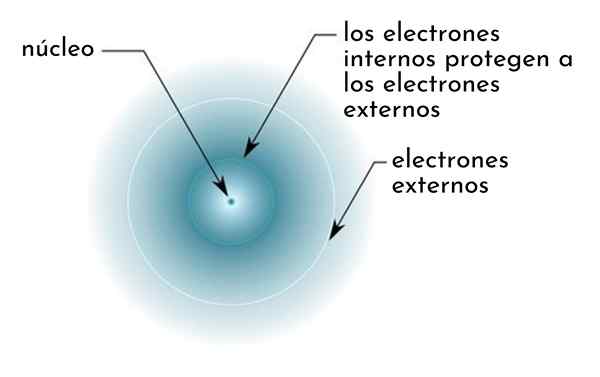
Hän suojausvaikutus Se koostuu eräänlaisesta suojasta, jonka muodostavat atomin sisäiset elektronit, jotka peittävät ytimen. Tämä tekee uloimmista elektroneista "tuntemaan" alemman vetovoiman ytimessä kuin he tuntevat, jos muita elektroneja ei olisi läsnä.
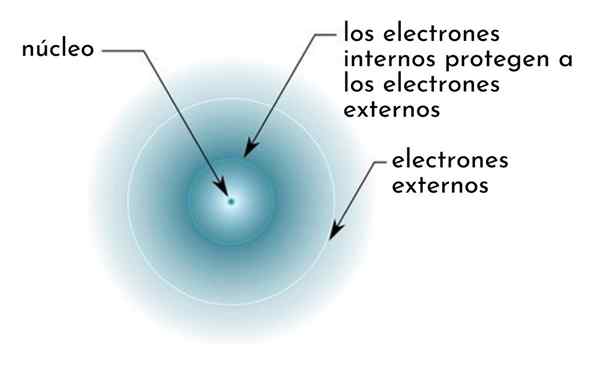 Kuva kaaviomaisesti sisäiset elektronit, jotka toimivat näytönä, joka suojaa ytimen vetovoiman ulkoiset elektronit
Kuva kaaviomaisesti sisäiset elektronit, jotka toimivat näytönä, joka suojaa ytimen vetovoiman ulkoiset elektronit Esimerkiksi natriumiatomin ydinkuorma on +11 (sen atomiluku on Z = 11), mutta sen hallussaan ainoa Valencian elektroni tuntee tosiasiallisesti vain +2,2: n kuormituksen vetovoiman.
Voi palvella sinua: Natriumbentsoaatti: rakenne, ominaisuudet, käytöt ja riskitToisin sanoen muiden 10 sisäisen elektronin suojaaminen aiheuttaa natriumin Valencia -elektronin tuntemaan vain viidennen ydinvoiman voiman, jonka pitäisi olla.
Suojausvaikutuksen lisäksi Elektronien välinen torjuminen (joilla on sama sähkövaraus) myötävaikuttaa myös ytimen kapasiteettiin houkutella ulkoisia elektroneja. Toisin sanoen tämä torjuminen auttaa myös vähentämään tehokasta ydinkuormaa.
Tärkeät tehokkaan ydinkuorman ominaisuudet
On huomattava, että tehokkaan ydinkuorman vähentämisestä vastaava suojavaikutus vaikuttaa vain samaan energiatasoon tai ylemmissä kerroksissa, mutta eivät kaikkein sisäisimpiin elektroneihin. Lisäksi vaikutus ei ole sama atomiorbitaalien S ja P löydetyille elektroneille kuin orbitaaleissa D ja F.
Tästä syystä jokaisen kerroksen tai energiatason elektronisarja tuntuu erilaiselta tehokkaalta ydinkuormasta. Tällä on tärkeitä vaikutuksia eri elementtien kemiallisiin ominaisuuksiin.
Efektiivisen ydinkuorman jaksollinen suuntaus
Aikana
Samalla energiatasolla sijaitsevat elektronit ovat vähemmän suojauksia kuin alhaisemmalla energiatasolla.
Tämän vuoksi suojausvaikutus ei kasva huomattavasti liikkuessamme ajanjakson aikana, mutta todellinen ydinkuorma tekee. Tästä syystä tehokas ydinkuorma kasvaa vasemmalta oikealle jaksollisessa taulukossa.
Koko ryhmän ajan
Toisaalta, kun kuljet jaksosta toiseen samassa ryhmässä (ts. Kun siirrymme alas ryhmää pitkin), lisätään kokonaiset kerrokset erittäin suojaavia sisäisiä elektroneja. Tämä saa tehokkaan ydinkuorman vähentymään ylhäältä alas tai, mikä on sama, kasvaa alhaalta ylöspäin.
Voi palvella sinua: AyaroínaTehokas ydinkuorman kaava
Tehokas ydinkuorma voidaan laskea hyvin yksinkertaisella puoliksi -aikayhtälöllä, joka ottaa huomioon ydinkuorman todellisen arvon (annetaan atomiluku, Z) ja termi, jota kutsutaan vakiosuojaksi. Jälkimmäinen kattaa muiden elektronien läsnäolon vaikutukset yhdessä.
Yhtälö annetaan:
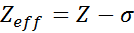
missä z on atomiluku ja σ (kreikkalainen kirjain Sigma) edustaa suojausvakiota, joka riippuu elektronisesta kokoonpanosta.
Slater -säännöt
Suojavakio voidaan arvioida järjestelmästä, joka tunnetaan nimellä Slater -säännöt. Nämä säännöt sallivat elektronin suojavakion laskemisen lisäämällä muiden elektronien osuudet mainitulle suojausvakiolle. Nämä säännöt voidaan tiivistää seuraavasti:
- Mikä tahansa elektroni, joka on samalla energiatasolla (taso n0 -) Tarjoaa määrän 0,35 suojavakion, elleivät molemmat ole tasolla 1, jolloin se tarjoaa 0,30.
- Jokainen elektroni, joka on heti edellisellä tasolla (tasolla n0 --1) kiertoradalla S tai P, se tuo 0,85; Toisaalta, jos se on kiertoradalla D tai F, se myötävaikuttaa 1.
- Kaikki muut elektronit, jotka ovat alhaisemmalla energiatasoilla (n0 --2, n0 --3, jne.), kirjoita 1 suojausvakioon.
Esimerkki tehokkaasta ydinkuorman laskelmasta
Natriumiatomin Valencia -elektroni
Natriumiatomin elektroninen konfiguraatio on 1s22s22 p63s1. Toisin sanoen, jos haluamme laskea tehokkaan ydinkuorman, jonka Valencia Electron tuntee (Electron 3S1), meidän on lisättävä muiden 10 elektronin panos Slaterin sääntöjen noudattamisen jälkeen.
Voi palvella sinua: rautaoksidi (II): rakenne, nimikkeistö, ominaisuudet, käyttötarkoituksetKuinka laskemme 3S -elektronisuojuksen vakiona1 (n0 -= 3) Ja tämä on yksin Valencia -kerroksessa, samalla energiatasolla ei ole muita elektroneja.
Välittömästi edellinen taso on n0 --1 = 2, jos kiertoradalla S tai P on 8 elektronia, jotka vaikuttavat 0,85, ja kiertoradalla ei ole elektroneja D tai F.
Lopuksi, ainoa alle 2 -taso on n = 1, jossa on vain 2 elektronia. Kaikki tämä on yhteenveto seuraavassa taulukossa:
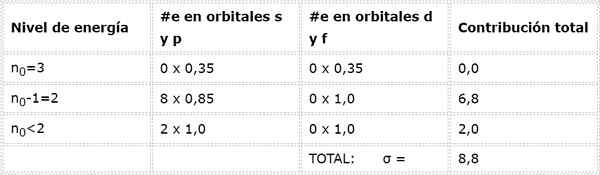
Kuten voidaan nähdä, natriumin sisäiset elektronit tarjoavat suojan vakiona 8,8, joten elektroni tuntee 3s: n tehokkaan ydinkuorman1 On:
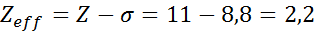
Arseeni Valencia -elektronit
Arseeni elektroninen kokoonpano on 1s22s22 p63s23P63D104S24P3. Valencia -kerros on kerros 4 (n0 -= 4) Siinä on 5 elektronia: (4S24P3-A. Tässä tapauksessa jokainen näistä viidestä elektronista tuntee muiden 4: n vaikutuksen, jotka ovat samassa kerroksessa ja muiden 28 sisäisen elektronin vaikutuksessa, kuten taulukossa on esitetty:
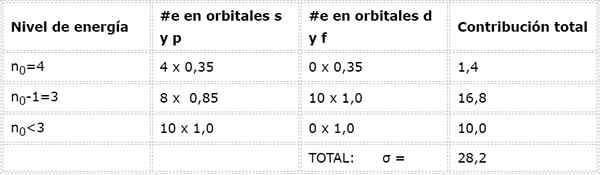
Siksi tehokas ydinkuorma, jonka arseeni Valencia -elektronit tuntevat, on: