Ketonien tyypit, ominaisuudet, nimikkeistö, käyttö, esimerkkejä
- 3291
- 962
- Dr. Travis Reichert
Se ketonit Ne ovat orgaanisia yhdisteitä, joissa on karbonyyliryhmä (-CO). Ne ovat yksinkertaisia yhdisteitä, joissa karbonyyliryhmän karboni on kytketty kahteen hiiliatomiin (ja niiden substituenttiketjuihin)). Ketonit ovat "yksinkertaisia", koska heillä ei ole reaktiivisia ryhmiä, kuten -OH tai -cl yhdistyneitä hiileen.
Polaarisiksi yhdisteiksi tunnistetut ketonit ovat yleensä liukoisia ja haihtuvia, mikä tekee niistä hyviä liuottimia ja lisäaineita hajuvesiin. Lisäksi niitä on helppo valmistaa, suhteellisen stabiili ja niillä on korkea reaktiivisuus, mikä on tehnyt niistä melkein täydellisen välituoteyhdisteen monimutkaisempien orgaanisten yhdisteiden valmistamiseksi.
 Ketonien yleinen kaava
Ketonien yleinen kaava Lopuksi ketonien eliminointi ihmiskehosta liittyy yleensä alhaiseen sokeritasoon (diabeetikoissa ja/tai äärimmäisissä paastotapauksissa), jotka voivat aiheuttaa vakavia terveysongelmia potilaalle.
[TOC]
Ketonien yleinen kaava
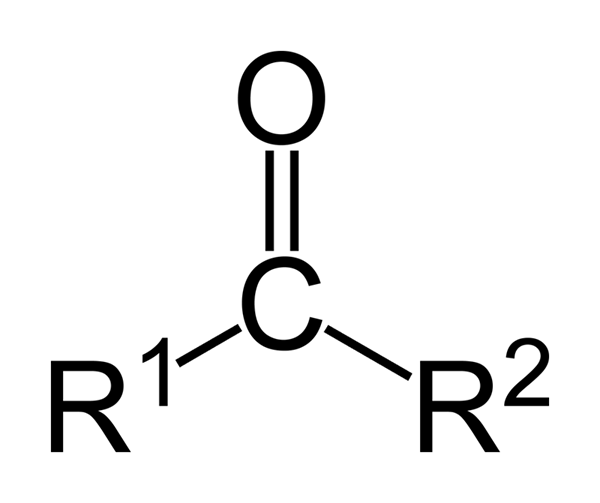
Ketonit ovat karbonyyliyhdisteitä, joissa tämä ryhmä on kytketty kahteen hiilivetyryhmään; Nämä voivat olla alkyyliryhmiä, bentseenirenkaiden ryhmiä tai molemmat.
Ketoni voidaan edustaa yksinkertaisesti nimellä R- (C = O) -r ', missä R ja R' ovat minkä tahansa hiilivety (alko, alkeenit, alkines, sykloalcanos, bentseenin johdannaiset ja muut) kaksi ketjua. Karbonyyliryhmään kiinnitettyä vetyä ei ole ketoneja.
Teollisuus- ja laboratorioalalla on laaja valikoima menetelmiä ketonien valmistukseen; Lisäksi on tärkeää huomata, että ketotonit voivat syntetisoida eri organismit, mukaan lukien ihmiset.
Teollisuudessa yleisin ketonien synteesimenetelmä sisältää hiilivetyjen hapettumisen, tyypillisesti ilman käytön myötä. Pienessä mittakaavassa ketonit valmistetaan yleensä sekundaaristen alkoholien hapettumisen kautta, mikä antaa setonan ja vesituotteet tuotteina.
Näiden yleisimpien menetelmien lisäksi ketonit voidaan syntetisoida alkeenien, alkynien, typpiyhdisteiden suolojen, esterien ja monien muiden yhdisteiden avulla, mikä tekee niistä helposti saadut.
Ketonien tyypit
Ketoneille on useita luokituksia, riippuen pääasiassa niiden R -ketjujen substituenteista. Näiden aineiden yleisimmät luokitukset on nimitetty alla:
Sen ketjun rakenteen mukaan
Tässä tapauksessa ketoni luokitellaan sen ketjun rakenteen avulla: alifaattiset ketonit ovat niitä, joilla on kaksi R- ja R -radikaalia, joilla on alkyyliradikaali muoto (alkaanit, alkeenit, alkines ja sykloalaanit).
Se voi palvella sinua: isoamyylialkoholi: rakenne, ominaisuudet, käytöt ja riskitToisaalta aromaattiset ovat ne, jotka muodostavat bentseenin johdannaisia, samalla kun ne ovat silti ketoneja. Lopuksi sekoitetut ketonit ovat niitä, joilla on alquilical ja radikaali r 'aril, tai päinvastoin.
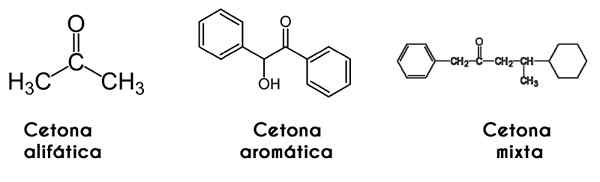 Vasemmalta oikealle: Propanona, Benzofrona ja fenyylimetilbutanoni. Wikimedia commons -kuvat.
Vasemmalta oikealle: Propanona, Benzofrona ja fenyylimetilbutanoni. Wikimedia commons -kuvat. Radikaalien symmetrian mukaan
Tässä tapauksessa karbonyyliryhmä tutkii R- ja R -radikaaleja; Kun nämä ovat samoja (identtisiä), ketoni kutsuu itseään symmetrisiksi; Mutta kun ne ovat erilaisia (kuten useimmat ketonit), se kutsuu itseään epäsymmetrisiksi.
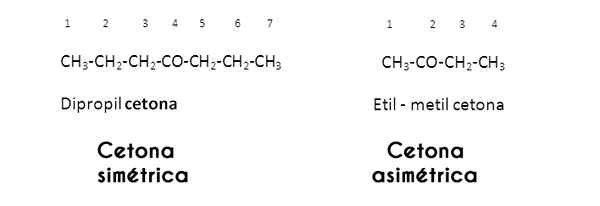 Kuvia Wikimedia Commonsin kautta.
Kuvia Wikimedia Commonsin kautta. Radikaalien kylläisyyden mukaan
Ketonit voidaan myös luokitella niiden hiiliketjujen kylläisyyden mukaan; Jos nämä ovat alkaanien muodossa, ketoni kutsuu itseään tyydyttyneeksi ketoniksi. Toisaalta, jos ketjut ovat kuin alkeenia tai alkineja, ketonia kutsutaan tyydyttymättömäksi ketoniksi.
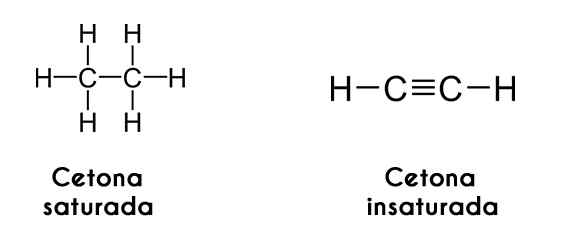 Vasemmalla, asetyleeni oikealla. Kuvia Wikimedia Commonsin kautta.
Vasemmalla, asetyleeni oikealla. Kuvia Wikimedia Commonsin kautta. Dicetonit
Tämä on luokka lukuun ottamatta Cetonaa, koska tämän ketonin ketjuissa on kaksi karbonyyliryhmää sen rakenteessaan. Joillakin näistä ketoneista on ainutlaatuisia ominaisuuksia, kuten suurempi linkin pituus hiilihiilien välillä.
Esimerkiksi sykloheksanista johdetut dicetonit tunnetaan nimellä Quinonas, jotka ovat vain kaksi: orto-bentsokinoni ja bentsokinoni.
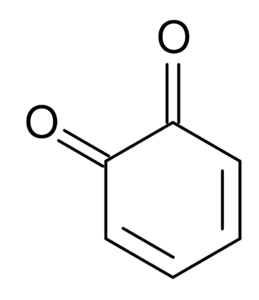 orto-bentsokinoni. Etelään englanniksi wikipedia / julkinen verkkotunnus
orto-bentsokinoni. Etelään englanniksi wikipedia / julkinen verkkotunnus Ketonien fysikaaliset ja kemialliset ominaisuudet
Ketonit, kuten useimmat aldehydosit, ovat nestemäisiä molekyylejä ja niillä on sarja fysikaalisia ja kemiallisia ominaisuuksia, jotka vaihtelevat niiden ketjujen pituuden mukaan. Sen ominaisuudet on kuvattu alla:
Kiehumispiste
Ketonit ovat erittäin haihtuvia, huomattavasti polaarisia eivätkä ne voi luovuttaa vety sidosten hydrogensseja (niillä ei ole vetyatomeja sidoksissa karbonyyliryhmäänsä), joten niillä on korkeammat kiehumispisteet kuin alkeenilla ja eettereillä, mutta alhaisemmat kuin saman molekyylipainon alkoholit.
Ketonin kiehumispiste kasvaa, kun molekyylin koko kasvaa. Tämä johtuu van der Waalsin ja dipolo-dipolon voimien puuttumisesta, jotka vaativat suuremman määrän energiaa houkuttelevien atomien ja elektronien erottamiseen molekyylissä.
Liukoisuus
Ketonien liukoisuudella on voimakas vaikutus osittain näiden molekyylien kykyä hyväksyä hydrogenssit niiden happiatomiin ja muodostaa siten vety sidoksen veteen. Lisäksi ketonien ja veden välisen vetovoiman, dispersion ja dipolin dipolin voimat, jotka lisäävät niiden liukoista vaikutusta, ovat voimia.
Voi palvella sinua: Rauta (elementti): Ominaisuudet, kemiallinen rakenne, käyttöKetonit menettävät liukoisuuskapasiteetin, sitä suurempi molekyyli, koska ne alkavat vaatia enemmän energiaa veteen liukenemiseen. Ne ovat myös liukoisia orgaanisiin yhdisteisiin.
Happamuus
Heidän karbonyyliryhmänsä ansiosta ketoneilla on hapan luonne; Tämä tapahtuu tämän funktionaalisen ryhmän hallussa olevan resonanssin stabilointikaapion vuoksi, mikä voi antaa sen kaksoissidoksen protoneja konjugoidun emäksen muodostamiseksi nimeltään ENOL.
Reaktiivisuus
Ketonit ovat osa suurta määrää orgaanisia reaktioita; Tämä johtuu sen karbonyylihiilen herkkyydestä nukleofiiliseen lisäykseen, tämän napaisuuden lisäksi.
Kuten edellä todettiin, ketonien suuri reaktiivisuus tehdään tunnustetulla välituotteella, joka toimii perustana muiden yhdisteiden syntetisoinnissa.
Nimikkeistö
Ketonit nimetään karbonyyliryhmän prioriteetin tai merkityksen mukaan koko molekyylissä, joten kun sinulla on karbonyyliryhmän hallitsema molekyyli, ketoni nimetään lisäämällä jälkiliite "-ona" hiili-aineen nimeen.
Pääketjuna pitää suuremman pituuden, joka karbonyyliryhmällä on, ja sitten molekyyli on nimetty. Jos karbonyyliryhmällä ei ole prioriteettia molekyylin muihin funktionaalisiin ryhmiin, niin se tunnistetaan "-oksolla".
Monimutkaisemmille ketoneille funktionaalisen ryhmän sijainti voidaan tunnistaa numerolla ja distonien tapauksessa (ketonit, joissa on kaksi substituenttia r ja r 'identtinen), molekyyli on nimetty jälkiliitteellä “-diona”.
Lopuksi sanaa "cetona" voidaan käyttää myös karbonyylifunktionaaliseen ryhmään kytketyt radikaaliketjut tunnistamisen jälkeen.
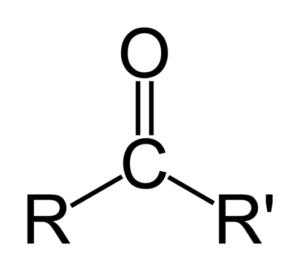
Ero aldehydojen ja ketonien välillä
Suurin ero aldehydien ja ketonien välillä on aldehydien karbonyyliryhmään kiinnitetyn vetyatomin läsnäolo.
Tällä atomilla on tärkeä vaikutus molekyylin sisällyttämiseen hapettumisreaktioon: Aldehydi muodostaa karboksyylihapon tai karboksyylihapon suolan riippuen siitä, tapahtuuko hapettuminen hapoissa vai emäksisissä olosuhteissa hapoissa tai emäksisissä olosuhteissa.
Toisaalta Cetonalla ei ole tätä vetyä, joten hapettumiseen tarvittavat vähimmäisvaiheet eivät tapahdu.
Ketonin hapettamiseksi on menetelmiä (hapettavien aineiden ollessa paljon tehokkaampia kuin tyypillisesti käytetyt), mutta ne rikkovat setonimolekyylin, erottaen sen ensin kahteen tai useampaan osaan.
Voi palvella sinua: fysiikan ja kemian ionisaatio: käsite, prosessi ja esimerkitTeollisuus- ja päivittäinen elämä käyttää
Teollisuudessa ketoneja havaitaan hajusteissa ja maalauksissa, jotka ottavat stabilointi- ja kondomipaperit, jotka estävät seoksen muita komponentteja hajoamasta; Heillä on myös laaja spektri liuottimina sellaisilla aloilla, jotka valmistavat räjähteitä, maalauksia ja tekstiilejä, lääkkeiden lisäksi.
Asetoni (pienin ja pienempi ketoni) on erittäin hyvin tunnistettu liuotinmaailma.
Luonnossa ketonit voivat ilmestyä sokereiksi, nimeltään ketusiksi. Ketosas ovat monosakkarideja, jotka sisältävät setonan molekyylillä. Tunnetuin ketoosi on fruktoosi, hedelmistä ja hunajasta löytyvä sokeri.
Eläinsolujen sytoplasmassa esiintyvien rasvahappojen biosynteesi tapahtuu myös ketonien vaikutuksella. Lopuksi, ja kuten edellä mainittiin, veressä voi olla ketotonien nousua paastoamisen jälkeen tai diabeetikoissa.
Esimerkkejä ketoneista
Butanona (C4H8JOMPIKUMPI)
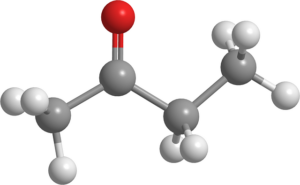 Butanonimolekyyli. Lähde: Pixabay.
Butanonimolekyyli. Lähde: Pixabay. Tätä nestettä tunnetaan myös nimellä MEK (tai MEC), laajassa mittakaavassa teollisuudessa ja sitä käytetään liuottimena.
Sykloheksanoni (C6H10JOMPIKUMPI)
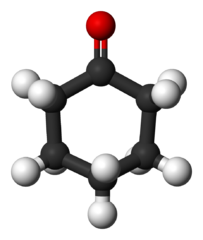 Sykloheksanonimolekyyli. Benjah-BMM27 / julkinen verkkotunnus
Sykloheksanonimolekyyli. Benjah-BMM27 / julkinen verkkotunnus Tätä ketonia tuotetaan valtavassa mittakaavassa nylon synteettisen materiaalin edeltäjänä.
Testosteroni (c19H22JOMPIKUMPI2-A
 Testosteronimolekyyli. Wikimedia Commons
Testosteronimolekyyli. Wikimedia Commons Se on miespuolisen sukupuolen päähormoni ja anabolinen steroidi, jota löytyy useimmista selkärankaisista.
Progesteroni (CkaksikymmentäyksiH30JOMPIKUMPI2-A
 Medroksiprogesteroniasetaatti, syklofemiinikomponentti
Medroksiprogesteroniasetaatti, syklofemiinikomponentti Endogeeninen steroidi ja seksuaalinen hormoni, joka osallistuu kuukautiskierrossa, raskaudessa ja alkionogeneesissä ihmisillä ja muilla lajeilla.
Asetoni (CH3(Co) ch3-A
 Asetoneyhdiste. Benjah-BMM27 / julkinen verkkotunnus
Asetoneyhdiste. Benjah-BMM27 / julkinen verkkotunnus Se tunnetaan myös nimellä Propanona, se on väritön yhdiste, jota käytetään erilaisten teollisuustuotteiden, kuten muovien, sekä kotikygieniatuotteiden ja kosmetiikan, kuten poisto.
Kortisoni (CkaksikymmentäyksiH28JOMPIKUMPI5-A
 Kortisoni. Benjah-BMM27 / julkinen verkkotunnus
Kortisoni. Benjah-BMM27 / julkinen verkkotunnus Steroidihormoni, jota käytetään tiettyjen vaivojen ja olosuhteiden, kuten tulehdusten, aknen, allergioiden ja muun tyyppisten ihoreaktioiden, astman tai syövän ja leukemian torjumiseksi.
Bentsofenona (C13H10JOMPIKUMPI)
 Bentsofenooma. Benjah-BMM27 / julkinen verkkotunnus
Bentsofenooma. Benjah-BMM27 / julkinen verkkotunnus Yhdiste, jota käytetään laajasti hajuvesien ja muiden kosmeettisten tai auringonsuojatuotteiden luomisessa sen aromaattisen koostumuksen takia.
Viitteet
- Wikipedia. (S.F.-A. Ketoni. Saatu.Wikipedia.org
- Britannica, e. (S.F.-A. Ketoni. Saatu Britannicalta.com
- Yliopisto, m. S. (S.F.-A. Aldehydit ja ketonit. Saatu kemiasta.MSU.Edu
- Kemina. (S.F.-A. Johdanto Aldehydit ja ketonit. Saatu Chemguidesta.yhteistyö.Yhdistynyt kuningaskunta
- Calgary, u. JOMPIKUMPI. (S.F.-A. Ketonit. Saatu kemikolta.Ucalgary.Ac

