Bentsoehappo (C6H5COOH)
- 4209
- 805
- Mr. Clifford Kshlerin
 Bentsoehappo on aromaattinen karboksyylihappo
Bentsoehappo on aromaattinen karboksyylihappo Mikä on bentsoehapoa?
Hän Bentsoehappo Se on kaikkien yksinkertaisin aromaattihappo, jolla on molekyylinen kaava C6H5Haittaa. Luonnossa sitä esiintyy lukuisissa kasveissa, etenkin hedelmissä, kuten aprikoosi ja mustikka. Sitä esiintyy myös bakteereissa aminohappofenyylialaniinimetabolian sivutuotteena.
Se syntyy suolistossa joissain elintarvikkeissa olevien polyfenolien bakteerien (oksidatiivinen) prosessoimalla.
C -c6H5COOH on toisin kuin monet hapot, kiinteä yhdiste, joka koostuu kevyistä, valkoisista ja filiformisista kiteistä, jotka antavat mantelin ja ominaisaromin.
Yksi bentsoehapon pääominaisuuksista on hiivan, homeen ja joidenkin bakteerien kasvun estäminen, joten sitä käytetään elintarvikkeiden säilöntäaineeksi.
Vaikka se ei ole erityisen myrkyllinen yhdiste, sillä on joitain haitallisia toimia terveydelle. Siksi kuka suosittelee maksimaalista saantoa 5 mg/kg ruumiinpainoa/päivä, mikä vastaa päivittäistä 300 mg: n bentsoehapoa.
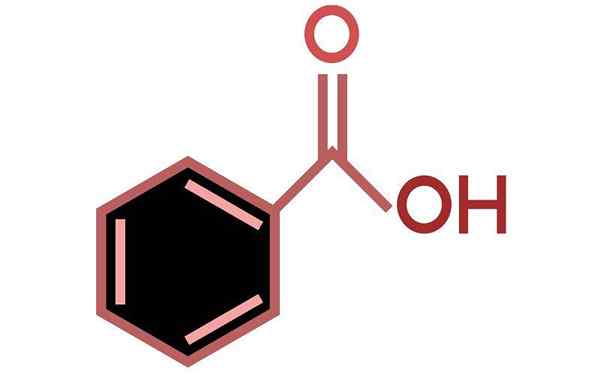
Bentsoehapon rakenne
 Bentsoehapon rakenne. Lähde: Wikimedia Commons
Bentsoehapon rakenne. Lähde: Wikimedia Commons Ylivoimainen kuva edustaa bentsoehapon rakennetta tangossa ja pallomallissa.
Jos mustien pallojen lukumäärä lasketaan, varmistetaan, että niitä on kuusi, ts. Kuusi hiiliatomia, kaksi punaista palloa vastaavat karboksyyliryhmän kahta happiatomia, -COOH, ja lopuksi valkoista palloa ovat vetyatomeja.
Vasemmalla puolella sinulla on aromaattinen rengas, jonka aromaattisuus on havainnollistettu epäjatkuvalla viivoilla renkaan keskellä. Ja oikealla puolella -COOH -ryhmä, joka on vastuussa tämän yhdisteen happoominaisuuksista.
Molekyyli, c6H5COOH: lla on tasainen rakenne, koska kaikilla sen atomeilla (paitsi vetyjä) on SP -hybridisaatio2.
Toisaalta -COOH -ryhmä, erittäin polaarinen, mahdollistaa pysyvän dipolin olemassaolon rakenteessa.
Tämä tosiasia johtaa C: hen6H5COOH voi olla vuorovaikutuksessa itsensä kanssa dipoli-dipolovoimien kautta. Erityisesti erityisillä vety silloilla.
Jos ryhmä -COOH havaitaan, havaitaan, että C = O: n happi voi hyväksyä vetysillan, kun taas O -H -happi luovuttaa ne.
Kide- ja vety sillat
Bentsoehappo voi muodostaa kaksi vety sillaa: vastaanottaa ja hyväksyy yhden samanaikaisesti. Siksi se muodostaa dímerosia, ts.
Nämä ovat pareja tai dimeerejä, c6H5Cooh-hoocc6H5, rakenteellinen perusta, joka määrittelee kiinteän aineen, joka johtuu sen suunnittelusta avaruudessa.
Voi palvella sinua: Diatomiset elementitBentsoehapon fysikaaliset ja kemialliset ominaisuudet
Kemialliset nimet
Happo:
-bentsoinen
-bentsenokarboksyyli
-Drasyyli
-Karboksibentseeni
-bentsenoforemiallinen
Molekyylikaava
C7H6JOMPIKUMPI2 tai c6H5Haittaa
Molekyylipaino
122 123 g/mol.
Fyysinen kuvaus
Kiinteä tai kiteiden muodossa, yleensä valkoinen, mutta voi olla beige -väri, jos siinä on tiettyjä epäpuhtauksia. Hänen kiteensä ovat kaaviota tai neula -muotoisia.
Haju
Se haisee mantelilta ja on mukava.
Maku
Mauton tai hieman katkera. Maun havaitsemisraja on 85 ppm.
Kiehumispiste
480º F A 760 mmHg (249 ºC).
Sulamispiste
252,3º F (121,5-123,5 ºC).
sytytyspiste
250º F (121 ºC).
Sublimaatio
Voi sublimoida 100 ºC: sta.
Vesiliukoisuus
3,4 g/l a 25 ºC.
Liukoisuus orgaanisiin liuottimiin
- 1 g bentsoehappoa liukenee tilavuuteen, joka on yhtä suuri kuin: 2,3 ml kylmää alkoholia, 4,5 ml kloroformia, 3 ml eetteriä, 3 ml asetonia, 30 ml hiilitetrakloridia, 10 ml bentseeniä, 30 ml hiilidisulfidia, eetteriä, 30 ml hiili -disulfidia, eetteriä, eetteriä, 30 ml hiili -disulfidia, eetteriä, eetteriä, 30 ml hiili -disulfidia, eetteriä, eetteriä, 30 ml hiili -disulfidia, eetteriä, eetteriä, 30 ml hiili -disulfidia, ja 2,3 ml Treem -öljyä.
- Se on myös liukoinen haihtuviin ja kiinteisiin öljyihin.
- Se on liukeneva öljyeetteriin.
- Hänen liukoisuus heksaanoon on 0,9 g/l, metanolissa 71,5 g/l ja tolueenissa 10,6 g/l.
Tiheys
1 316 g/ml 82,4º F: ssa ja 1 2659 g/ml 15 ° C: ssa.
Höyrytiheys
4,21 (ilmansuhteen ollessa referenssinä = 1)
Höyrynpaine
1 mmHg nopeudella 205º F ja 7,0 x 10-4 MMHG 25 ° C: ssa.
Vakaus
Liuos, jonka pitoisuus on 0,1% vedessä, on stabiili vähintään 8 viikon ajan.
Hajoaminen
Se hajoaa lämmittämällä, säteilemällä hehtaaria ja ärsyttävää savua.
Goo
1,26 CPOise nopeudella 130 ºC.
Palamislämpö
3227 kJ / mol.
Höyrystyslämpö
534 kJ /mol nopeudella 249 ºC.
PHE
Noin 4 vettä.
Pintajännitys
31 N/M A 130 ºC.
Pka
4,19 - 25 ºC.
Taitekerroin
1 504-1 5397 (ηD) 20 ºC: n lämpötilassa.
Reaktiot
- Kosketuksessa emäksien kanssa (NaOH, KOH, jne.) Muodostavat bentsoatin myyntiä. Esimerkiksi, jos reagoit NaOH: n kanssa, natriumbentsoaattimuoto, c6H5Polku.
- Reagoi alkoholien kanssa estereiden muodostamiseksi. Esimerkiksi sen reaktio etyylialkoholiin on peräisin etyyliesteristä. Jotkut bentsoehappoesterit täyttävät funktiot pehmittiminä.
- Reagoi fosforin pentakloridin kanssa, PCL5, Bentsoilin kloridin muodostamiseksi happohalogenidi. Bentsoilikloridi voi reagoida ammoniumin kanssa (NH3) tai amiinia, kuten metyyliamiini (CHO3Nh2) Bentsamidin muodostamiseksi.
- Bentsoehapon reaktio rikkihapon kanssa tuottaa aromaattisen renkaan sulfonaation. Funktionaalinen ryhmä -so3H Korvaa vetyatomin renkaan kohdeasennossa.
Se voi palvella sinua: Ensimmäinen kemian vallankumous- Se voi reagoida typpihapon kanssa käyttämällä rikkihappoa katalyyttinä, muodostaen meta-nitrobentsoehapon.
- Katalyytin läsnä ollessa, kuten ferrikloridi, FECL3, Bentsoehappo reagoi halogeenien kanssa. Esimerkiksi se reagoi kloorin kanssa metaklorobentsoehapon muodostumiseksi.
Tuotanto
Jotkut tämän yhdisteen tuotantomenetelmät:
- Suurin osa bentsoehaposta tapahtuu teollisesti hapettamalla tolueenia ilmassa olevan hapen kanssa. Prosessia katalysoi kobolttibensiini lämpötilassa 140-160 ºC ja paineessa 0,2-0,3 MPa.
- Tolueeni voidaan kloorinoida bentsotrikloridin tuottamiseksi, joka hydrolysoidaan myöhemmin bentsoehapolla.
- Bentsonitriili- ja bentsamidihydrolyysi, happamassa tai alkalisessa väliaineessa, voivat aiheuttaa bentsoehapoa ja sen konjugoituja emäksiä.
- Bentsyylialkoholi kaliumpermanganaatin välittämässä hapettumisessa vesipitoisessa väliaineessa tuottaa bentsoehapoa. Reaktio tapahtuu lämmittämällä tai palautuspalautuksella. Kun prosessi on valmis, seos suodatetaan mangaanidioksidin poistamiseksi, kun taas supernatantti jäähdytetään bentsoehapon saamiseksi.
- Bentsokikloridiyhdiste reagoi kalsiumhydroksidin kanssa käyttämällä katalyytteinä rautaa tai rautasuoloja, muodostaen aluksi kalsiumbentsoaatin, CA (C (C6H5Kujertaa)2. Sitten tämä suola muuttuu bentsoehapoksi reaktiolla suolahappon kanssa.
Bentsoehappo käyttää
Teollisuuden edustajat
- Sitä käytetään fenolin tuotannossa bentsoehapon oksidatiivisella dekarboksylaatiolla lämpötiloissa 300-400 ºC, koska fenolia voidaan käyttää nylonin synteesissä.
- Siitä bentsoaattiglykoli, esterin dietyleeniglykolin kemiallinen esiaste ja trietyleeniglykolesteri, muokkaamisina käytetyt aineet. Ehkä tärkeimmät pehmittimien levitykset ovat tarttuvat formulaatiot. Joitakin pitkät ketjut esterit käytetään muovien, kuten PVC: n, pehmentämiseen.
- Sitä käytetään kumipolymeroinnin aktivaattorina. Lisäksi se on välittäjä alquidic -hartsien valmistuksessa sekä lisäaineita sovelluksille raakaöljyn talteenotossa.
- Lisäksi sitä käytetään hartsien, väriaineiden, kuitujen, torjunta -aineiden ja polyamidihartsin modifiointiaineen kehittämisessä polyesterin tuotantoon. Sitä käytetään tupakan aromin ylläpitämiseen.
Voi palvella sinua: binaarisuolat- Se on Benzoil -kloridin edeltäjä, joka on aloitusmateriaali yhdisteiden, kuten bentsyylibentsoaatin synteesille, jota käytetään keinotekoisten makujen ja hyönteisten kehittämisessä.
Lääketieteellinen
- Se on osa Whitfield -voitoa. Tämä voide koostuu 6% bentsoehaposta ja 3% salisyylihaposta.
- Se on bentsoiinin tinktuurin ainesosa, jota käytetään henkisenä ajankohtaisena ja dekongestanttina antiseptisenä. Sitä käytettiin odotettavissa olevana, kipulääkkeenä ja antiseptisenä 1900 -luvun alkuun saakka.
- Bentsoehappoa on käytetty potilaiden kokeellisessa hoidossa.
Elintarvikkeiden säilyttäminen
- Bentsoehapoa ja sen suoloja käytetään elintarvikkeiden säilyttämisessä. Yhdiste kykenee estämään muotin, hiivan ja bakteerien kasvua pH -riippuvaisen mekanismin avulla.
Hankala
Voi reagoida joidenkin juomien läsnä olevan askorbiinihapon (C -vitamiini) kanssa, tuottaen bentseeniä, syöpää aiheuttavia yhdisteitä. Tämän vuoksi etsitään muita yhdisteitä kyvyllä säästää ruokia, jotka eivät aiheuta bentsoehapon ongelmia.
Toiset
- Sitä käytetään aktiivisessa pakkauksessa, joka on läsnä ionomeereissä. Heistä vapautuu bentsoehappo, joka kykenee estämään suvulajien kasvua Penisillium ja Aspergillus Mikrobien väliaineissa.
- Sitä käytetään hedelmä- ja hajuvesimehun aromin säilöntäaineena.
- Bentsoehappoa käytetään selektiivisenä rikkakasvien torjunta -aineena rikkakasvien hallitsemiseksi leveillä ja ruohoilla soijapavuissa, kurkuissa, meloneissa, maapähkinöissä ja puumaisissa koristekasveissa.
Myrkyllisyys
- Kosketuksessa ihon ja silmien kanssa se voi tuottaa punoitusta. Hengittämällä voi aiheuttaa hengityselinten ärsytystä ja yskää. Suurten bentsoehapon määrien saanti voi aiheuttaa maha -suolikanavan häiriöitä, jotka voivat saavuttaa maksa- ja munuaisvauriot.
- Bentsoehappo ja bentsoaatit voivat vapauttaa histamiinia, joka voi aiheuttaa allergisia reaktioita ja silmien, ihon ja limakalvojen ärsytystä.
- Siinä ei ole kumulatiivista, mutageenista tai syöpää aiheuttavaa vaikutusta, koska se imeytyy nopeasti suolistossa, eliminoi virtsassa kertymättä kehoon.
- Suurin sallittu annos WHO: n mukaan 5 mg/kg kehon painoa/päivä, noin 300 mg/päivä. Akuutti toksisuusannos ihmisillä: 500 mg/kg.
Viitteet
- Bentsoehappo. Palautettu kemikaalikirjasta.com
- Bentsoehappo. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus
- Bentsoehappo. Haettu jstk.Wikipedia.org

