Karboksyylihappo
- 1130
- 215
- Sheldon Kuhn
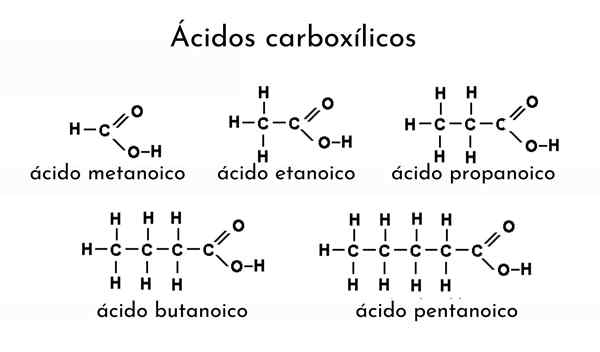
 Esimerkkejä karboksyylihapoista
Esimerkkejä karboksyylihapoista Mitkä ovat karboksyylihapot?
Hän karboksyylihappo Se on termi, joka on annettu jokaiselle orgaaniselle yhdisteelle, joka sisältää karboksyyliryhmän. Niitä voidaan kutsua myös orgaanisiksi hapoiksi, ja niitä on läsnä monissa luonnollisissa lähteissä. Esimerkiksi muurahaisten ja muiden hyönteisten, kuten galleriittikuoriaisen, muurahaishappo, karboksyylihappo tislataan.
Toisin sanoen muurahainen on lähde, jossa on runsaasti muurahaishappoa. Myös etikkahappo uutetaan etikasta, räätälän voin haju johtuu butrihaposta, valeria -yrtit sisältävät aivohappoa ja saatujen kapteenien, kaikki nämä karboksyylihappot, korkkeista, jotka saatiin kaaprihappoa, kaikki nämä karboksyylihappot.
Maitohappo antaa hapan maidon huonon maun, ja joissain rasvoissa ja öljyissä rasvahapoja on. Esimerkkejä luonnollisista karboksyylihapon lähteistä ovat lukemattomia, mutta kaikki niiden määritetyt nimet ovat johdettu sanoista latinaksi. Siten latinalaisessa sanassa formika tarkoittaa "muurahaista".
Koska nämä hapot uutettiin historian eri luvuissa, nämä nimet olivat yleisiä, vakiinnuttaen populaarikulttuurissa.
Kaava
Se Karboksyylihapon yleinen kaava on -r -cooh, tai yksityiskohtaisempi: R- (c = o) -OH. Hiiliatomi on kytketty kahteen happiatomiin, mikä aiheuttaa sen elektronisen tiheyden vähentymisen ja siten positiivisen osittaisen kuorman.
Tämä kuorma heijastaa hiilen hapettumistilaa orgaanisessa yhdisteessä. Missä tahansa muussa hiili on yhtä ruosteinen kuin karboksyylihappojen tapauksessa, tämä hapettuminen on verrannollinen yhdisteen reaktiivisuuden asteeseen.
Tästä syystä ryhmällä -COOH: lla on vallitseva muihin orgaanisiin ryhmiin ja määrittelee yhdisteen pääkarvaidun luonteen ja pääkarvaisen ketjun.
Siksi amiinien happojohdannaisia (R-NH2), mutta aminot, jotka on peräisin karboksyylihapoista (aminohapot).
Nimikkeistö
Latinalaisesta karboksyylihapoista johdetut yleiset nimet eivät selventä yhdisteen rakennetta tai niiden atomiryhmiensa järjestelyä tai sijoittamista.
Näiden selvennyksien tarpeen vuoksi syntyy IUPAC -systemaattinen nimikkeistö karboksyylihappojen nimeämiseksi.
Voi palvella sinua: Bromi: Historia, rakenne, elektroninen kokoonpano, ominaisuudet, käyttöTätä nimikkeistöä säätelevät useat säännöt, ja jotkut näistä ovat:
Sääntö 1
Karboksyylihappon mainitsemiseksi sen alkaanin nimeä on muokattava lisäämällä ”ICO” -liite. Siten etaanille (valitse3-CH3) sen vastaava karboksyylihappo on etanoehappo (CH3-COOH, etikkahappo, sama etikka).
Toinen esimerkki: CHO: lle3CH2CH2-COOH EL Alcanosta tulee butaania (ch3CH2CH2CH3) ja siksi butaanihapon (butiacaph.
Sääntö 2
-COOH -ryhmä määrittelee pääketjun, ja kutakin hiiltä vastaava luku lasketaan karbonyylistä.
Esimerkiksi Cho3CH2CH2CH2-COOH on pentaanihappo, joka laskee yhdestä viiteen hiilihiiliin metyyliin (valitse3-A. Jos toinen metyyliryhmä on kytketty kolmanteen hiileen, se olisi CHO3CH2Ch (ch3) Ch2-COOH, joka on tuloksena oleva nimikkeistö nyt: 3-metyylipentaanihappo.
Sääntö 3
Substituentteja edeltää sen hiilen lukumäärä, johon ne on linkitetty. Samoin nämä substituentit voivat olla kaksois- tai kolminkertaisia linkkejä ja lisätä ”ICO” -liitteen yhtäläisesti alkeeneille ja alkineille. Esimerkiksi Cho3CH2CH2Ch = chch2-COOH mainitaan happona (cis tai trans) 3-heptenoicina.
Sääntö 4
Kun R -ketju koostuu renkaasta (φ). Happo mainitaan renkaan nimellä ja päättyy "karboksyyliseen" jälkiliitteeseen. Esimerkiksi φ-cooh on nimetty bentsekenokarboksyylihapoksi.
Karboksyylihapporakenne
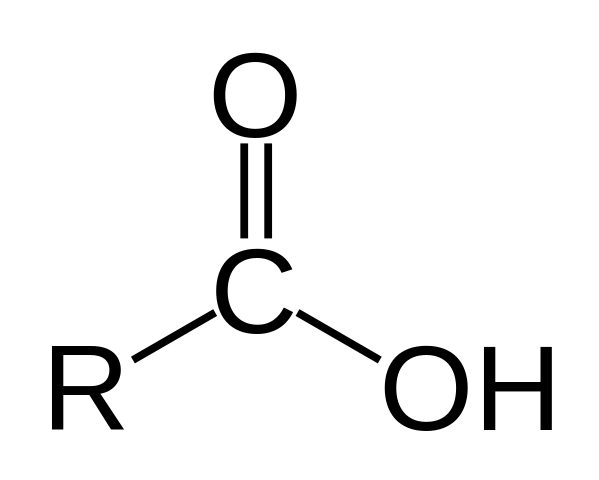 Karboksyylihapon rakenne. R on vety tai hiilihapotettu ketju.
Karboksyylihapon rakenne. R on vety tai hiilihapotettu ketju. Yläkuvassa on esitetty karboksyylihapon yleinen rakenne. Sivuketju r voi olla minkä tahansa pituisen tai hallussaan kaikenlaisia substituentteja.
Hiiliatomilla on SP -hybridisaatio2, jonka avulla voit hyväksyä kaksoissidoksen ja luoda linkkikulut noin 120º.
Siksi tämä ryhmä voidaan rinnastaa tasaiseksi kolmioksi. Ylähappi sisältää runsaasti elektroneja, kun taas alempi vety on huono elektroneissa, ja siitä tulee happea vety (elektronia vastaanottaja). Tämä on havaittavissa kaksoissidoksen resonanssirakenteissa.
Vety osoitetaan kohti emäksistä, ja tästä syystä tämä rakenne vastaa happoa yhdistettä.
Voi palvella sinua: amiesitKarboksyylihappoominaisuudet
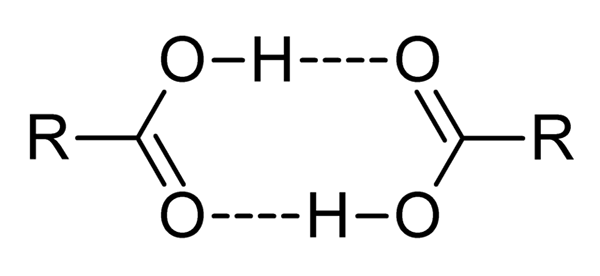
Karboksyylihapot ovat erittäin polaarisia yhdisteitä, voimakkaita hajuja ja helppo vuorovaikutuksessa toistensa kanssa vety silloilla, kuten ylivoimainen kuva on havainnollistettu.
Kun kaksi karboksyylihappoa ovat vuorovaikutuksessa tällä tavalla, dímerot muodostuvat, jotkut ovat riittävän stabiileja olemassaoloon kaasufaasissa.
Vety- ja halkaisijaltaan sillat aiheuttavat karboksyylihappojen korkeammat kiehumispisteet kuin vedellä. Tämä johtuu siitä, että lämmössä annetun energian on haihduttava paitsi molekyyli, myös dimeeriin, myös näiden vety sillan kytkettynä.
Pienet karboksyylihapot tuntevat suuren affiniteetin veteen ja polaarisiin liuottimiin. Kuitenkin, kun hiiliatomien lukumäärä on suurempi kuin neljä, R -ketjujen hydrofobinen luonne hallitsee ja muuttuu vedellä sekoittumaton.
Kiinteässä tai nestemäisessä vaiheessa R -ketjun pituudella ja sillä on tärkeä rooli. Siten, kun ketjut ovat erittäin pitkiä, ne ovat vuorovaikutuksessa keskenään Lontoon dispersiovoimien kautta, kuten rasvahappojen tapauksessa.
Happamuus
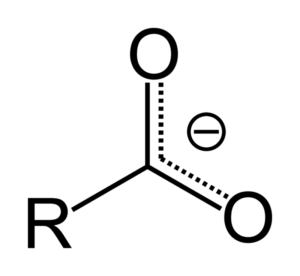
Kun karboksyylihappo luovuttaa protonin, siitä tulee ylemmässä kuvassa esitetty karboksylaatti -anioni,. Tässä anionissa negatiivinen kuorma siirretään kahden hiiliatomin väliin, stabiloimalla ja siksi suosimalla reaktiota.
Kuinka vaihtelee tätä happamuutta yhdestä karboksyylihapoista toiseen? Kaikki riippuu protonin happamuudesta OH -ryhmässä: mitä köyhempi elektroneissa, sitä enemmän happoa.
Tätä happamuutta voidaan lisätä, jos yksi RA -ketjun substituenteista on elektronegatiivisia lajeja (joka houkuttelee tai vetää elektronisen tiheyden ympäristöstä).
Esimerkiksi, jos CHO: ssa3-COOH korvataan H -metyyliryhmän h fluoriatomilla (CFH2-COOH) happamuus kasvaa huomattavasti siksi, että F vetää elektronisen tiheyden karbonyylistä, hapesta ja sitten vedystä. Jos kaikki H korvataan F: llä (vrt3-COOH) happamuus saavuttaa maksimiarvonsa.
Voi palvella sinua: vety: historia, rakenne, ominaisuudet ja käytötMikä muuttuja määrittää happamuuden asteen? Pk-lla. Mitä alempi pk-lla Ja lähempänä yhtä, suurempi on hapon kyky dissosioitua vedessä ja puolestaan vaarallisempi ja haitallisempi. Edellisestä esimerkistä vrt3-COOH: lla on alhaisin PK -arvo-lla.
Karboksyylihappojen käyttö/sovellukset
Karboksyylihappojen valtavan valikoiman vuoksi jokaisella näistä on potentiaalinen sovellus teollisuudessa, olipa kyse sitten polymeereistä, lääkkeistä tai elintarvikkeista.
Ruokateollisuus
- Lisäaineet.
- Säilöntäaineet (sorbiinihappo ja bentsoehappo).
- Monien tuotteiden emäksisen säädin.
- Virvoitusjuomien tuotanto.
- Antimikrobiset aineet ennen antioksidanttien vaikutusta. Tässä tapauksessa trendi on nestemäinen antimikrobinen.
- Yleisen etikan pääosa (etikkahappo).
- Haposeuranhappo- ja ruokia (sitruunahappo ja maitohappo).
- Assistentti sveitsiläisen juuston kypsymisessä (propionihappo).
- Juusto, chucrut, fermentoitu colm ja virvoitusjuomat (maitohappo).
Lääketeollisuus
- Antipenettinen ja kipulääke (asetyylisalisyylihappo).
- Aktiivinen aromisynteesiprosessissa, joissain lääkkeissä (butiar- tai butaanihappo).
- Antimikoottinen (bentsoehappo yhdistettynä salisyylihapon kanssa).
- Aktiivinen C -vitamiinilääkkeiden (askorbiinihappo) valmistukseen.
- Sienitautien (kapriilihappo).
- Joidenkin laksatiivien valmistus (hydroksibothanodiumhappo).
Muut teollisuudenalat
- Muovien ja voiteluaineiden valmistus (sorbiinihappo).
- Lakan, elastisten hartsien ja läpinäkyvien liimojen (akryylihappo) valmistus.
- Maalausten ja lakkaiden valmistus (linolihappo).
- Saippuat, pesuaineet, shampoot, kosmetiikka ja metallipuhdistustuotteet (öljyhappo).
- Hammaspastavalmistus (salisyylihappo).
- Rayon -asetaattituotanto, valokuvakalvot ja liuottimet maaleille (etikkahappo).
- Väriaine ja parkittu tuotanto (metaanihappo).
- Voiteluaineöljyjen, vedenpitävien materiaalien ja maalausten valmistus (palmitiinihappo).
- Kumivalmistus (etikkahappo).
- Kumin yksityiskohta ja galvanoplastia.
- Liuotin.
- Hajuveden tuotanto (bentsoehappo).
- Pehmittimien ja hartsien valmistus (valokuvahappo).
- Polyesterikeskukset (tereftallihappo).
- Parafiinikynttilöiden valmistus (steariinihappo).
Viitteet
- Graham Solomons t.W -., Craig B. Freedle. Orgaaninen kemia. Karboksyylihapot ja niiden johdannaiset (10. painos., sivu 779-783). Wiley Plus.
- Orgaaniset hapot. NaturyWellbeing toipui.com
- Francis a. Kilpikonnan. Orgaaninen kemia. Karboksyylihapot. (Kuudes painos., Sivu 805-820). MC Graw Hill.
- William Reusch. Karboksyylihapot. Kemiasta palautettu.MSU.Edu

