Píchric happo mikä on, rakenne, synteesi, ominaisuudet
- 2027
- 57
- Arthur Terry II
Hän Píchric happo Se on erittäin nitrado-orgaaninen kemiallinen yhdiste, jonka nimi IUPAC on 2,4,6-trinitrofenoli. Sen molekyyl kaava on c6H2(EI2-A3vai niin. Se on erittäin happama fenoli, ja sitä voidaan löytää natriumpikraattina, ammoniumina tai kaliumina; eli sen ionisessa muodossa C6H2(EI2-A3Ona.
Se on vankka katkera, ja sieltä johdetaan sen nimen kreikkalaisesta sanasta 'prikos', mikä tarkoittaa katkeraa. Se löytyy märkänä keltaisina kiteinä. Sen kuivuminen tai kuivuminen on vaarallista, koska se lisää epävakaita ominaisuuksia, jotka tekevät siitä räjähtävän.
Píchrichacea käytetään perustana pysyvien keltaisten sävyvärimien synteesille. Jotkut patologit ja tutkijat käyttävät sitä kudosleikkeiden ja muiden immunohistokemiallisten prosessien kiinnittämisessä tai värjäyksessä.
Se on erittäin hyödyllinen lääketuotteiden kehittämisessä. Lisäksi sitä käytetään otteluiden tai otteluiden ja räjähteiden kehittämisessä. Sitä käytetään myös metallien tallentamiseen, värillisen lasin valmistamiseen ja biologisten parametrien, kuten kreatiniinin, kolorimetriseen määrittämiseen.
Rakenne
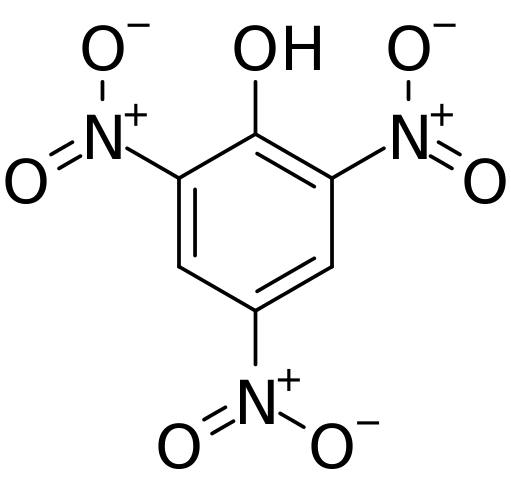
 Rakenne ja muodolliset kuormat pykrorihapossa. Lähde: CVF-PS [julkinen alue]
Rakenne ja muodolliset kuormat pykrorihapossa. Lähde: CVF-PS [julkinen alue] Yläkuvassa kaikki sidokset ja Píchricihappomolekyylin rakenne on esitetty yksityiskohtaisemmin. Se koostuu fenolista, jolla on kolme nitro -substituenttia.
Voidaan nähdä, että ryhmissä ei2 Typpiatomilla on positiivinen osittainen kuorma, ja siksi sen ympäristöstä elektronisen tiheyden kysyntä. Mutta aromaattinen rengas houkuttelee myös elektroneja itseään kohti ja ennen kolmea ei2 lopulta antaa osan omasta elektronisesta tiheydestään.
Tämän seurauksena OH -ryhmän happi pyrkii enemmän jakamaan yhden vapaista elektronisista ikäisistään renkaan kärsimän elektronisen puutteen toimittamiseksi; Ja niin tekemällä linkki C = O on muodostettu+-H. Tämä hapen positiivinen osittainen kuormitus heikentää O-H-sidosta ja happamuus kasvaa; toisin sanoen se vapautuu vety -ionina, H+.
Happofenoli
Tästä syystä tämä yhdiste on poikkeuksellisen vahva happo (ja reagenssi), jopa enemmän kuin etikkahappo itse. Yhdiste on kuitenkin todella fenoli, jonka happamuus ylittää muiden fenolien happamat; Kuten juuri maininnut, substituentit eivät2.
Voi palvella sinua: termodynaamiset prosessitSiksi, koska se on fenoli, OH -ryhmällä on prioriteetti ja ohjaa luettelon rakenteessa. Kolme ei2 Ne sijaitsevat aromaattisen renkaan hiilihiilissä 2, 4 ja 6 suhteessa OH. Tästä johdetaan tämän yhdisteen IUPAC-nimikkeistö: 2,4,6-trinitrofenoli (TNP).
Jos ryhmät eivät olleet2, Tai jos renkaassa olisi pienempi määrä, O-H-linkki heikentyisi vähemmän, ja siksi yhdisteellä olisi vähemmän happamuutta.
Kiteinen rakenne
Pycrcriccriccriccriccriccriccriccriccriccriccric -Molekyylit tilataan siten, että ne suosivat molekyylien välisiä vuorovaikutuksia; joko vetyjen siltojen muodostumiseen OH -ryhmien välillä eikä2, Dipolo-dipolo-voimat tai sähköstaattiset heijastukset köyhien elektronien välillä.
Voitaisiin odottaa, että ryhmät eivät2 He hylkäävät toisiaan ja ohjeet naapurimaiden aromaattisten renkaiden suuntaan. Samoin renkaat eivät voineet kohdistaa yhtä päällekkäin sähköstaattisten torjumien lisääntymisen vuoksi.
Kaikkien näiden vuorovaikutusten seurauksena Píchrichcric Happo onnistuu muodostamaan kolmiulotteisen verkon, joka määrittelee kiteen; jonka yhtenäinen solu vastaa ortorromisen tyypin kiteistä järjestelmää.
Synteesi
Aluksi se syntetisoitiin muun muassa luonnollisista yhdisteistä, kuten eläinten sarven johdannaisista, luonnollisista hartsista. Vuodesta 1841 lähtien fenolia on käytetty pikarihappojen edeltäjänä useiden reittien jälkeen tai useiden kemiallisten toimenpiteiden kautta.
Kuten jo sanottiin, se on yksi happamimmista fenoleista. Sen syntetisoimiseksi vaaditaan ensin, että fenoli kärsii sulfonaatioprosessista, jota seuraa nitraatiomenettely.
Veinen fenolin sulfonaatio suoritetaan fenolia hoidettaessa savun rikkihapolla, esiintyen H: n aromaattisia elektrofyylisiä substituutioita sulfonaattiryhmillä, joten niin3H, asemassa -orto ja -Para suhteessa OH -ryhmään.
Tämä tuote, 2,4-pynoldisulfonihappo, nitraatioprosessi suoritetaan, käsittelemällä sitä konsentroituneella typpihapolla. Näin toiminnassa nämä kaksi ryhmää3H korvataan nitroryhmillä, ei2, Ja kolmasosa tulee toiseen nitroasentoon. Seuraava kemiallinen yhtälö kuvaa tätä:
Voi palvella sinua: elastiset materiaalit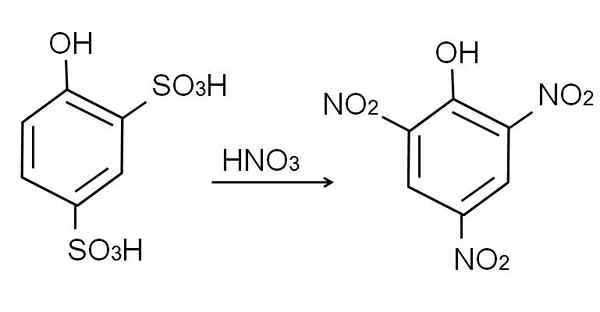 Happamat nitraatio 2,4-fenoldisulfonic. Lähde: Gabriel Bolívar.
Happamat nitraatio 2,4-fenoldisulfonic. Lähde: Gabriel Bolívar. Fenolin suora nitraatio
Fenolin nitraatioprosessia ei voida suorittaa suoraan, koska korkean molekyylipainon kohteet syntyvät. Tämä synteesimenetelmä tarvitsee lämpötilan erittäin huolellisen hallinnan, koska se on hyvin eksoterminen:
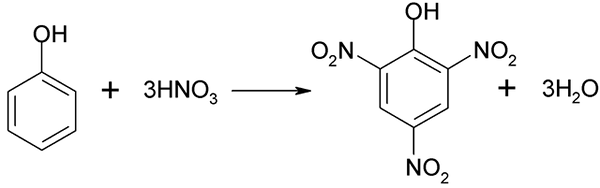 Fenolin suora nitraatio. Lähde: Akane700 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Fenolin suora nitraatio. Lähde: Akane700 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Píchricihappo voidaan saada suoritettaessa 2,4-dinitrofenolin suoraa nitraatioprosessia typpihapolla.
Toinen synteesin muoto on bentseenin käsittely typpihapolla ja elohopeana nitraatilla.
Fysikaaliset ja kemialliset ominaisuudet
Molekyylipaino
229.104 g/mol.
Fyysinen ulkonäkö
Keltainen märkä kiteitä.
Haju
Se on wc.
Maku
Se on erittäin katkera.
Sulamispiste
122.5 ° C.
Kiehumispiste
300 ° C. Mutta sulaa, se räjähtää.
Tiheys
1,77 g/ml.
Liukoisuus
Se on kohtalaisen vesiliukoinen yhdiste. Tämä johtuu siitä, että OH -ryhmäsi ei2 Ne voivat olla vuorovaikutuksessa vesimolekyylien kanssa vety silloilla; Vaikka aromaattinen rengas on hydrofobinen, ja siksi se vahingoittaa liukoisuuttaan.
Syövyttävyys
Pycrikihappo on yleensä metalleille syövyttävä, paitsi tina ja alumiini.
Pka
0,38. Se on vahva orgaaninen happo.
Epävakaus
Píchricihappolle on ominaista epävakaat ominaisuudet. Se on ympäristölle riski, se on epävakaa, räjähtävä ja myrkyllinen.
Se on säilytettävä hyvin suljettuna kuivumisen välttämiseksi, koska pikarihappo on erittäin räjähtävä, jos sen annetaan kuivua. Sinun on oltava erittäin varovainen sen vedettömän muodon suhteen, koska se on erittäin herkkä kitkalle, iskuille ja lämmölle.
Pychral -happo tulisi varastoida tuuletettuihin, tuoreet kohdat, kaukana hapettuvista materiaaleista. On ärsyttävää koskettua ihon ja limakalvojen kanssa, sitä ei pidä nauti, ja se on myrkyllinen keholle.
Sovellukset
Píchricihappoa on käytetty laajasti tutkimusalueella, kemiassa, teollisuudessa ja armeijan alalla.
Tutkinta
Kun sitä käytetään solu- ja kudosten kiinnitystä, se parantaa niiden värituloksia happovärillä. Se tapahtuu trikromisten väritysmenetelmien kanssa. Kun se on asettanut kankaan formaliiniin, suositellaan uutta kiinnitystä Píchric -hapolla.
Voi palvella sinua: Paina suodatin: Ominaisuudet, osat, miten se toimii, käyttääTällä tavoin on taattu intensiivinen ja erittäin kirkas väri kudoksista. Hyvät tulokset saadaan perusväriaineilla. Varotoimenpiteitä on kuitenkin.
Orgaaninen kemia
-Orgaanisessa kemiassa sitä käytetään emäksisinä picratesina eri aineiden tunnistamiseksi ja analysoimiseksi.
-Käytetään metallianalyyttisessä kemiassa.
-Kliinisissä laboratorioissa sitä käytetään seerumin ja virtsatasojen määrittämisessä kreatiniinia.
-Sitä on käytetty myös joissakin reagensseissa, joita käytetään glukoositasojen analysointiin.
Teollisuudessa
-Valokuvateollisuuden tasolla píchrichacea on käytetty herkistäjänä valokuvaemulsioissa. On ollut osa muun muassa tuotteiden, kuten torjunta -aineiden, vahvojen hyönteismyrkkyjen, kehittämistä.
-Píchricin happoa käytetään syntetisoimaan muita välikemiallisia yhdisteitä, kuten kloropikriiniä ja pikramicalihappoa, esimerkiksi. Näistä yhdisteistä on kehitetty joitain lääkkeitä ja väriaineita nahkateollisuudelle.
-Píchricihappoa käytettiin palovammojen, kuten antiseptisten ja muiden tilojen, hoidossa ennen sen toksisuuden osoittamista.
-Tärkeä komponentti räjähtävän luonteensa mukaan otteluiden ja paristojen kehittämisessä.
Sotilashakemus
-Píchrichcrichacen suuren räjähtävyyden vuoksi sitä on käytetty sotilasaseiden ampumatarvikkeissa.
-Píchricihappoa puristettu ja valettu tykistön ammukseihin, pumppuihin ja kaivoksiin on käytetty.
-Pycriccriccric Ammonium Suolaa on käytetty räjähteenä, se on erittäin voimakas, mutta vähemmän stabiilisuus kuin TNT. Jonkin aikaa sitä käytettiin rakettipolttoainekomponenttina.
Myrkyllisyys
On todistettu, että se on erittäin myrkyllinen ihmisen organismille ja yleensä kaikille eläville olennoille.
Sen on suositeltavaa välttää sen hengitystä ja nauttimista akuutin suun myrkyllisyyden vuoksi. Se aiheuttaa myös mutaation mikro -organismeissa. Se aiheuttaa myrkyllisiä vaikutuksia villieläimiin, nisäkkäisiin ja yleensä ympäristössä.
Viitteet
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Purduen yliopisto. (2004). Happohapon räjähdys. Haettu: Chemed.Kemia.Purduke.Edu
- « Patricia Bennerin elämäkerta, teoria ja muut panokset
- Maguey mikä on, ominaisuudet, elinympäristö, lisääntyminen »

