Sulfámiinihapporakenne, ominaisuudet, synteesi, käyttää
- 1977
- 235
- Arthur Terry II
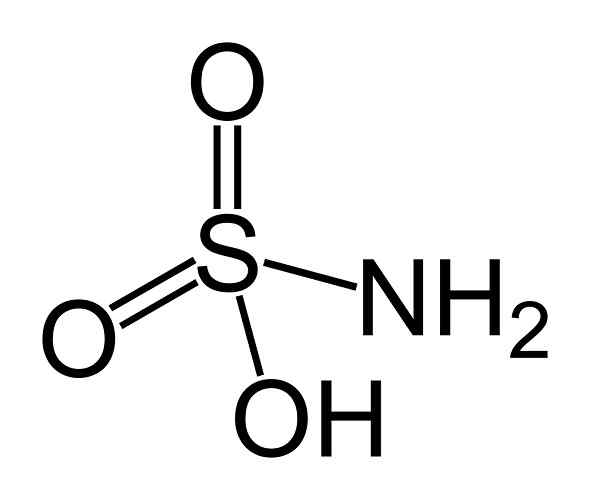
Hän sulfamihappo Se on epäorgaaninen yhdiste, joka on muodostettu kovalenttiseen muotoon kiinnittyneellä rikki- (S) atomilla ja yksinkertaisella linkillä hydroksyyliryhmään (-OH) ja aminoryhmään (-NHH2) ja kaksois sidoksella kahteen happiatomiin (O). Se on valkoinen kiteinen kiinteä. Sen kemiallinen kaava on NH2Sw3H. Sitä kutsutaan myös nimellä aminosulfonihappo, amidosulfonihappo, amidosulfuriinihappo ja sulfamidihappo.
Sulfámiehappo on vahva happo. Voit reagoida metallien, metallien ja karbonaattioksidien kanssa. Sen suolat ovat yleensä liukenevia veteen, joten se on hyvä poisto prosessilaitteissa. Sitä käytetään usein sokeritehtaissa karbonaattien puhdistamiseen höyrystimissä.
 Sulfámihapon rakenne. Benjah-BMM27 [julkinen alue]. Lähde: Wikipedia Commons.
Sulfámihapon rakenne. Benjah-BMM27 [julkinen alue]. Lähde: Wikipedia Commons. Sulfámiinihappo on nitriittien pelkistin (ei2-) ja tätä kemiallista ominaisuutta käytetään useissa sovelluksissa, kuten väriaine- ja nitriittien analyysissä.
Sitä on käytetty nahkaparkunassa ja massan valkaisussa paperinvalmistukseen. Itse asiassa se on ruoan epäpuhtaus, koska sitä usein löytyy papereista ja korteista, joita käytetään päivittäistavarakauppojen pakkaamiseen.
Sitä käytetään myös metallielektrodissa, laboratoriokuviona ja yksi sen johdannaisista on erittäin tehokas rikkakasvien torjunta -aine.
[TOC]
Rakenne
Sulfamihappo kiteytyy bipiramidaalisten ortorrombuskiteiden muodossa. Muodosta kompaktit prismat ja arkit kiteytyessään kylmästä liuoksesta, samoin kuin rhombuslevyjä, kun se tekee siitä kuuman vesipitoisen liuoksen.
Nimikkeistö
- Sulfamihappo
- Aminosulfonihappo
- Amidosulfonihappo
- Amidosulfuriinihappo
- Sulfami
Ominaisuudet
Fyysinen tila
Valkoinen kiteinen kiinteä.
Molekyylipaino
97,1 g/mol.
Sulamispiste
205 ºC, hajoaa 209 ºC: n nopeudella.
Tiheys
2,15 g/cm3
Liukoisuus
Liukoinen veteen:
- 12,8% - 0 ºC
- 17,57% 20 ° C: ssa
- 22,77% 40 ° C: ssa
Tuskin liukoinen metanoliin, liukenevat hieman asetoniin, liukenematon eetteriin.
Liukenevat vapaasti typpimäntäihin ja orgaanisiin liuottimiin, jotka sisältävät typpeä.
Liukenematon hiilidisulfidiin (CS2) ja hiilitetrakloridi (CCL4-A.
PHE
0,41 (liuoksessa 1 N, ts. 1 ekvivalentti/l).
Dissosiaatiovakio
0,101 - 25 ºC.
Kemialliset ominaisuudet
Se on vahva happo. Lähes yhtä paljon kuin suolahapot (HCL), typpi3) ja rikki (H2Sw4-A.
Voi palvella sinua: hapetetut yhdisteet: ominaisuudet, reaktiot, käyttötarkoituksetVesipitoiset sulfamiinihappoliuokset ovat voimakkaasti ionisoituja. Sen pH ovat alhaisemmat kuin muurahaisten, fosfori- ja oksaalihappojen liuokset.
Vedessä sulfamiinihappo menettää vain protonin, joka on sitoutunut happea. Typen liittyvät hydrogeneet pysyvät tiukasti yhtenäisinä.
Vesipitoisessa liuoksessa se hydrolysoidaan hitaasti ammoniumihapposulfaatin saamiseksi (NH4HSO4-A. On vakaa kuivissa olosuhteissa.
Sulfámiehappo hyökkää metalleja, metallioksideja ja karbonaatteja sulfamaattien tuottamiseksi. Esimerkiksi kaliummetallilla (k) kaliumsulfamaatilla (Koso2Nh2) ja vety (H2-A.
Kaikki sulfamihapon suolat ovat liukenevia veteen. Kalsium-, lyijy- ja bariumsuolat ovat hyvin liukoisia veteen, toisin kuin vastaava rikkihappo.
Typpihappo (HNO2) reagoi kvantitatiivisesti sulfamihapon aminohuryhmän kanssa vapauttaen typpeä (n2-A. Arvioidaan, että sulfamaatti -ioni toimii tässä reaktiossa amidana, ei amiinina.
Kloori-, bromi- tai kaliumkloraati hapetetaan sulfámihapon muuntamaan sen rikkihappoksi. Tätä reaktiota ei tapahdu muiden hapettimien, kuten kromihapon tai kaliumpermanganaatin kanssa.
Se ei ole yhteensopiva (reagoi) voimakkaan alkalin, kloorin, hypoklorihapon, hypokloriittien, syanidien ja sulfidien kanssa.
Muut ominaisuudet
Se ei ole hygroskooppista (tämä tarkoittaa, että se ei absorboi ilman kosteutta).
Lämmitettynä, kunnes hajoaminen säteilee erittäin myrkyllisiä rikkioksidien ja vetykloridin (HCL) höyryjä.
Yksi sen johdannaisista, ammoniumsulfamaatti, on palon hidastin.
Se on kohtalaisen myrkyllinen.
Synteesi
Sulfámiinihappo saadaan urea -CO -reaktiolla (NH2-A2 Tupakoinnin rikkihapolla, toisin sanoen rikkihappo (H2Sw4) konsentraatti, joka sisältää rikkitrioksidia (niin3-A.
Se voidaan myös syntetisoida reagoimalla klorosulfonihappo (HCLO3Cl) ja ammoniakki (NH3-A.
Sovellukset
Väritysteollisuudessa
Sulfámiinihappoa käytetään ylimääräisten nitriittien poistamiseen nopeasti ja tehokkaasti diatsotisointireaktioissa värityssynteesissä. Se on paljon käytännöllisempi kuin urea tähän tarkoitukseen.
Nahkakäsittelyssä
Nahkaparkituksen aikana sulfamihapon käyttö rikkihapon sijasta tarjoaa ohuemman ja silkkisen tekstuurin.
Voi palvella sinua: metallimineraalitLisäksi, koska kalsiumsulfamaatti on vesiliukoista, toisin kuin kalsiumsulfaatti, sulfámiinihappoa voidaan käyttää hajotetussa prosessissa jättämättä pisteitä, joita esiintyy joskus nahassa käytettäessä rikkihappoa käytettäessä.
 Nahkajalkine. Lähde: Pixabay.
Nahkajalkine. Lähde: Pixabay. Puhdistusprosessin laitteissa
Sulfámiinihappoa käytetään karhunpoistojen puhdistusaineena keiteissä, reaktoreissa, putkissa, jäähdytysjärjestelmissä ja lämmönvaihtimissa.
Näissä laitteissa muodostetaan tulosten tai prosessin yhdisteiden kiertämistä varten energiakasveissa, kemiallisissa kasveissa, lähestymistavoissa, paperitehtaissa, puristusasemissa ja muissa toimialoissa.
Sulut tai kiinteät kerrostumat voivat olla orgaanisia (leviä, lietettä, sieniä) tai epäorgaanisia (rautaoksidit, rautasulfidit, kalsium- tai magnesiumkarbonaatit, sulfaatit, fosfaatit tai silikaatit).
Sulfámiinihappo on erittäin tehokas, kun sitä käytetään kalsiumkarbonaatin tulosten poistamiseen. Sitä voidaan käyttää kuparilaitteissa, messingissä, ruostumattomassa teräksessä, valuraudassa ja galvanoidussa teräksessä.
Sitä käytetään 5-10-prosenttisessa liuoksessa painon mukaan. Sitä käytetään erityisesti sokeritehtaissa puhdistamaan valuraudasta valmistettuja höyrystimiä kuparilämmönvaihtimilla.
 Höyrystimen joukkue sokerimyllyssä. Kirjoittaja: Antksh Kumar. Lähde: Pixabay
Höyrystimen joukkue sokerimyllyssä. Kirjoittaja: Antksh Kumar. Lähde: Pixabay Sitä tulisi käyttää lämpötiloissa, jotka ovat enintään 50-60 ºC. 70 ºC -lämpötilat johtavat liukenemattomien sulfaattien, kuten tapauksen, muodostumiseen4.
Kun sitä käytetään yhdistettynä natriumkloridiin, synergian vaikutus tapahtuu ja liuos mahdollistaa rautaoksidin liukenemisen hitaasti. Tässä tapauksessa sitä ei pidä käyttää ruostumattoman teräksen kanssa, koska suolahappo vapautuu, mikä voi aiheuttaa korroosiota kyseisessä materiaalissa.
Metallien jalostuksessa
Metallielektrodepositio, kuten kupari, hopea, koboltti, nikkeli, sinkki, kadmium, rauta ja lyijy, voidaan suorittaa onnistuneesti sulfamiinihappoliuoksissa. Tätä voidaan käsitellä paljon helpommin kuin hydrofable happahappo (H2SIF6-A.
Mallireagenssina laboratoriossa
Ottaen huomioon tiettyjä sulfamihapon ominaisuuksia, kuten: sen voima happona, sen helppo puhdistaa vedessä kiteyttämisellä, sen stabiilisuus ja ei-hydroskooppisuus, sitä on käytetty ensisijaisena standardina laboratoriotasolla. Tämä tarkoittaa, että sitä käytetään kvantitatiivisiin emäksisiin määrityksiin.
 Laboratorio-. Julkinen. Lähde: Pixabay
Laboratorio-. Julkinen. Lähde: Pixabay Nitriittien analyysissä
Niiden helpon reaktion vuoksi nitriittien kanssa käytetään näiden liuoksen määrittämiseen.
Voi palvella sinua: trikloorieetikkahappo: rakenne, ominaisuudet, synteesi, käyttö, vaikutuksetVesianalyysissä liuenneen veteen
Koska reagoiva sulfamiinihappo vesitriittien kanssa vapautuu typpeä, on mahdollista määrittää veteen liuotettu happi, koska nitriittien aiheuttamat häiriöt eliminoidaan.
Typpioksidin valmistuksessa
Sulfámiinihappo reagoi typpihapon kanssa, joka tuottaa typpioksidia (n2JOMPIKUMPI). Tämä reaktio on turvallisempaa kuin ammoniumnitraatti mainitun kaasun saamiseksi.
Maataloudessa
Sulfámihapon johdannainen, ammoniumsulfamaatti, on ei -toksinen rikkakasvien torjunta -aine eläimille.
Kaste levitetään sen lajien levyille, jotka poistetaan kesän lopussa tai syksyn alussa, mieluiten kostealla säällä. Siirtäessäsi yhdisteen lehdistä juuriin, kasvi kuolee.
 Rocíon rikkakasvien torjunta -aine. Kirjoittaja: Zefe Wu. Lähde: Pixabay
Rocíon rikkakasvien torjunta -aine. Kirjoittaja: Zefe Wu. Lähde: Pixabay Tämän yhdisteen toinen etu on, että maa ei steriloi pysyvästi. Itse asiassa jonkin verran ammoniumsulfamaattia typpeä on saatavana maassa kasvien kasvua varten seuraavan kauden aikana.
Palonkehässä
Sen yhteensopivuus selluloosan ja palon hidastimen ominaisuuksien kanssa muuntaa ammoniumsulfamaatin agentiksi palon resistenttien kankaiden ja paperin saamiseksi.
Käytetään 10% kankaan painosta, joiden ulkonäkö ja kosketustunnus pysyvät muuttumattomina. Kangas, kun se on käytössä.
Se on hyödyllinen erityisesti teattereissa tai vastaavissa paikoissa.
 Teatteri. Kirjoittaja: Mustangjoe Lähde: Pixabay
Teatteri. Kirjoittaja: Mustangjoe Lähde: Pixabay Erilaisissa sovelluksissa
Sitä käytetään katalysaattorina joissakin kemiallisissa reaktioissa, kuten urea-formalde-hartsien valmistuksessa. Se on hyödyllinen myös bakteerisidinä ja kloorin stabilisaattorina uima -altaissa ja puisen massan valkaisuaineena massassa ja paperitehtaissa.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Sulfamihappo. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus
- Williams, D.Lens.H. (2004) Nitrosaatio typpikeskuksissa. Nitrosaatioreaktioissa ja typpioksidin kemiassa. kappale 2. ScienEdirect.com
- Clapp, leallyn b. (1943). Sulfamiinihappo ja sen käyttö. Kemia. Koulutus. 1943, 20, 4, 189. Pubista toipunut.ACS.org
- McDonald, James. (2003). Sulfamihappo. VeoliawaterTechistä toipunut.com
- Sastri, V.S. (2010). Korroosion hallinta ja hallinta. Shreirin korroosiossa. ScienEdirect.com
- Bajpai Pratima. (2018). Sekalaiset aiheet. Biermannin massan ja paperin käsikirjassa. Kolmas painos. ScienEdirect.com

