Kineettinen entsyymi
- 4124
- 753
- Alonzo Kirlin
Mikä on entsymaattinen kinetiikka?
Se Kineettinen entsyymi Se on tutkimusala, jossa fysikakemia ja biokemia kohtaavat entsyymien katalysoimien kemiallisten reaktioiden tutkimiseksi. Entsyymit ovat biologisia katalyyttejä, jotka lisäävät kemiallisen reaktion nopeutta vähentämällä niiden aktivointienergiaa.
Entsyymit katalysoivat erittäin tärkeitä kemiallisia reaktioita elämän ylläpitämiselle. Heillä on sekä pH että optimaalinen lämpötila katalyyttisen vaikutuksensa käyttämiseksi substraatilla, joten ne ovat välttämättömiä tekijöitä heidän toiminnan tutkimuksessa.
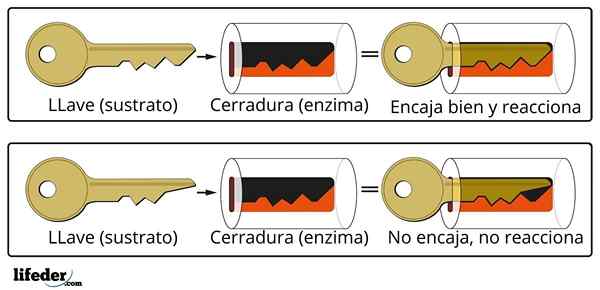
 Avaimen sulkemisjärjestelmä on likimääräinen analogia substraatti-entsyymijärjestelmään.
Avaimen sulkemisjärjestelmä on likimääräinen analogia substraatti-entsyymijärjestelmään. Entsyymi on vuorovaikutuksessa substraatin kanssa sen proteiiniketjun erikoistuneen alueen kautta, jota kutsutaan aktiiviseksi keskukseksi, jonka kolmiulotteinen rakenne on kytketty substraattirakenteeseen. Aktiivisen keskuksen ja substraatin välinen vuorovaikutus on yleensä heikko eikä kovalenttinen.
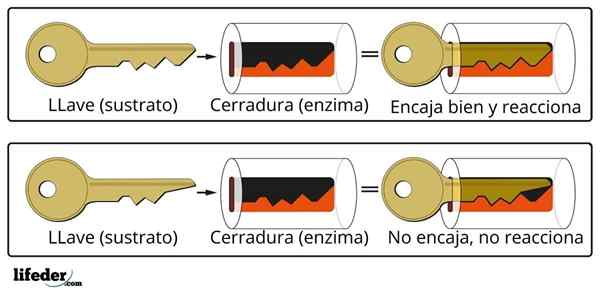
Aktiivisten entsyymikeskusten lukumäärä on rajallinen, mikä tuottaa kylläisyytensä substraattimolekyyleillä, mikä puolestaan estää reaktion nopeuden kasvavan tietyn arvon yli, tunnetaan nimellä maksiminopeus.
Entsymaattinen kinetiikka ei vain yhdistä biokemiaa ja fysikaalis -kemiaa, vaan myös bioinorgaanista, supramolekulaarista kemiaa, laskennallista kemiaa ja tilastoja.
Sitä kuvaavien mallejen joukossa on Michaelis -Menc. Nykyään se on edelleen yksi malleista, joita käytetään eniten kuvaamaan entsymaattista kinetiikkaa.
Peruskonseptit entsymaattisessa kinetiikassa
Entsymaattinen katalyysi
Entsyymit ovat proteiineja, joilla on katalyyttisiä aktiivisuuksia, jotka kykenevät toimimaan substraatin molekyyliin, katalysoimalla sen muutosta toiseksi tuotteeksi, joka tunnetaan tuotteina. Entsyymejä ei kuluteta katalyyttisen vaikutuksensa aikana, pysyen jatkuvan massansa aikana.
Katalyyttinen aktiivisuus
Entsyymin katalyyttinen aktiivisuus suoritetaan erikoistuneessa kolmiulotteisessa rakenteessa, joka tunnetaan nimellä Active Center. Tämä muodostuu entsymaattisen proteiiniketjun taitoksella, joka määrittää aktiivisen keskuksen muodostavien aminohappojen vuorovaikutuksen.
Aktiivinen keskus
Aktiivinen keskus ei ole jäykkä rakenne, mutta kykenee geometrisesti sopeutumaan substraattiin vuorovaikutuksessa sen kanssa. Vuorovaikutus on yleensä heikko (van der Waals -voimat), vaikka on entsyymejä, jotka muodostavat kovalenttisen yhteyden substraattiin.
Voi palvella sinua: Butiarus -rasva: hankkiminen, tyypit, koostumus, käytöt, edutVähentynyt aktivointienergia
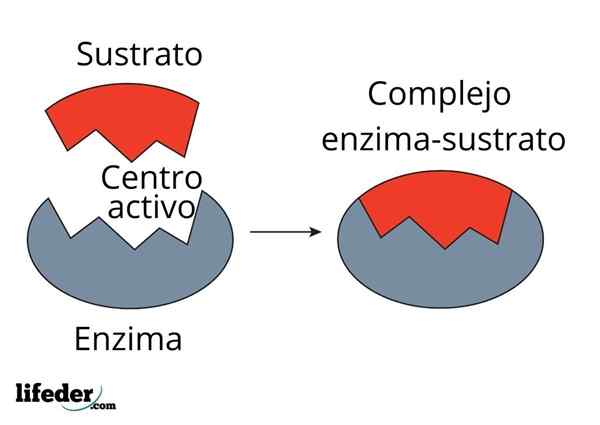
 Hiilihydraasin entsyymi vähentää aktivointienergiaa CO2: lle H2CO3 -muuntamiseen. Lähde: FVASCONCELLOS (Talk • Acculs), CC BY-SA 3.0, Wikimedia Commons
Hiilihydraasin entsyymi vähentää aktivointienergiaa CO2: lle H2CO3 -muuntamiseen. Lähde: FVASCONCELLOS (Talk • Acculs), CC BY-SA 3.0, Wikimedia Commons Entsyymit katalysoivat reaktioita, jotka vähentävät aktivointienergiaa, ja siksi vähentävät myös vapaan energiankulutusta (g), joka on välttämätöntä katalysoidun prosessin loppuun saattamiseksi. Entsyymit eivät modifioida ei -katalysoimattomien kemiallisten reaktioiden tasapainopistettä.
Huomaa, kuinka hiilihydraasin entsyymi vähentää aktivointienergiaa Co -Conversionin kannalta2 h: lle2Yhteistyö3. Vaikka etäisyys punaisen ja sinertävän viivan välillä ei vaikuta paljon, tämä entsyymi lisää nopeutta miljoonien kertojen luokkaa (106), verrattuna suoritettuun reaktioon ilman heidän osallistumistaan.
Stereoespesifisyys
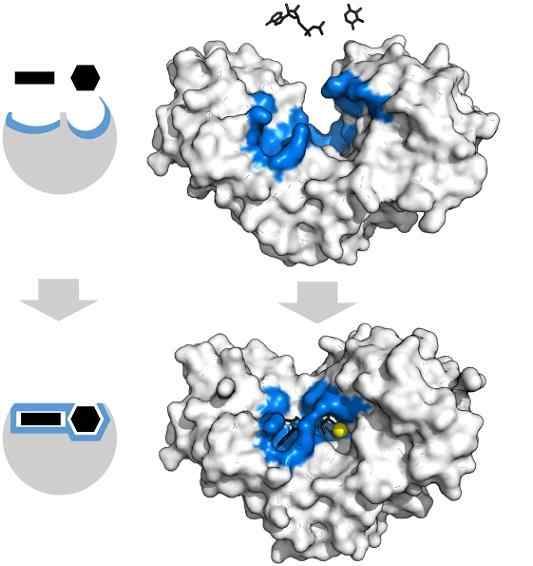 Adenosiinisubstraatit Tryfosfaatilla ja ksyloosilla on ominaismuoto, joka vastaa heksakinaasientsyymin aktiivisen keskuksen geometriaa. Lähde: Thomas Shafee, CC 4: llä.0, Wikimedia Commons
Adenosiinisubstraatit Tryfosfaatilla ja ksyloosilla on ominaismuoto, joka vastaa heksakinaasientsyymin aktiivisen keskuksen geometriaa. Lähde: Thomas Shafee, CC 4: llä.0, Wikimedia Commons Entsyymit ovat yleensä erittäin spesifisiä niiden katalysoimien reaktioiden suhteen, koska substraattimolekyylien on oltava vuorovaikutuksessa aktiivisen keskuksen kanssa, joka asettaa joukon vaatimuksia niiden kytkemiseen.
Siten esimerkiksi proteiiniketjujen molekyylin värähtelyn aiheuttama heksakisinaasin aktiivinen keskus, tarjoaa ryhmiä tarkalla alueellisella suuntauksella siten, että adenosiini- ja ksyloosin adenosiinimolekyylit, kalkki ikään kuin ne olisivat geometrisiä kappaleita.
Pienin fysikaalinen tai kemiallinen häiriö, ja sininen -heksokinaasialue eivät enää sovi substraateihin.
Enimmäisnopeus
Entsyymeillä on rajoitettu määrä aktiivisia keskuksia, joten lisäämällä substraattipitoisuutta. Tämä määrää, että katalysoidun reaktion nopeus ei voi kasvaa tietyn arvon yli, joka tunnetaan nimellä maksiminopeus.
Lämpötilaherkkyys ja pH
Entsymaattinen katalyyttinen aktiivisuus riippuu lämpötilasta ja pH: sta, joilla on näiden parametrien optimaaliset arvot sen toimintaan. Samoin, koska se on entsyymiproteiinimolekyylit, ne ovat alttiita kemialliselle tai lämpö denaturoinnille.
Kofaktorit
Jotkut entsyymit lisäävät niiden katalyyttistä aktiivisuutta tiettyjen tekijöiden vaikutuksesta, jotka voivat olla metalleja tai orgaanisia yhdisteitä, jotka tunnetaan nimellä koentsyymejä.
Samoin entsyymejä voidaan estää kilpailukykyisesti ja ei -kilpailijoita. Ylhäällä olevan heksokinaasin tapauksessa MG2+ (keltainen pallo) toimii kofaktorina.
Entsymaattinen reaktionopeus
Entsymaattisen reaktion nopeus riippuu substraatin ja entsymaattisen pitoisuuden pitoisuudesta. Kun substraattipitoisuus on alhainen, entsymaattisen nopeuden ja substraattipitoisuuden välillä on melkein lineaarinen suhde.
Se voi palvella sinua: ei metalleja: historia, ominaisuudet, ryhmät, käyttötarkoituksetSiksi entsymaattinen nopeus kasvaa suorassa suhteessa substraattipitoisuuteen; Mutta lisäämällä substraatin konsentraatiota arvoon, joka kyllästää entsyymin aktiiviset kohdat, suurin nopeus saavutetaan.
Kun entsymaattinen nopeus tapahtuu, siitä tulee vakio, ts. Se on riippumaton substraattipitoisuudesta ja sanotaan, että entsymaattinen nopeus on nolla. Lisäksi katalyyttinen entsymaattinen nopeus on verrannollinen entsyymi-substraattikompleksin pitoisuuteen [IS].
Kuten matemaattinen ilmaisu osoittaa:
V = k2[ON]
Suurin nopeus on suoraan verrannollinen entsyymin kokonaispitoisuuteen, kuten se esiintyy seuraavassa kaavassa:
VMax = KKissaJAt
K -k -Kissa Se on kierto- tai korvausnumero ja edustaa substraattimolekyylien lukumäärää, jonka kukin entsymaattinen paikka muuntaa tuoteksi aikayksikköä kohti. Sillä aikaat edustaa katalyyttisten entsymaattisten kohtien lukumäärää. Joot Sillä on korkea arvo, tarvitaan korkeampi [s] aktiivisten kohtien tai keskuksien kyllästymiseksi.
Michaelis -mente -yhtälö
Malli
Mihaelis -mente -malli perustuu yksinkertaiseen substraattiin vaikuttavien entsyymien vaikutukseen eikä sitä voida soveltaa alosteisiin entsyymeihin; toisin sanoen ne, joilla on aktiivisen kohdan katalyyttisen aktiivisuuden sääntelyalue.
Entsyymeillä alhaisella substraatin pitoisuudella on katalyyttinen aktiivisuus, joka on lineaarinen substraatin pitoisuuden kanssa; Mutta korkeissa substraattipitoisuuksissa katalyyttinen aktiivisuus on riippumaton substraattipitoisuudesta.
Vuonna 1913 Leonor Michelis ja Maudin ajatteli ehdottivat mallia, joka selittää ilmoitetun entsymaattisen käyttäytymisen, entsyymi-sustrato-välittäjäkompleksin olemassaolo [on] merkitystä mallissa [IS].
Yleinen yhtälö
Tämän kompleksin suhde entsymaattisen prosessin muihin komponentteihin sekä niihin liittyvät vakiot (k) on merkitty seuraavassa järjestelmässä:
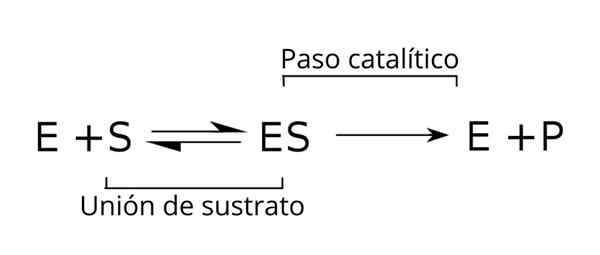 Substraattien yleinen yhtälö, entsyymi-substraattikompleksi ja entsymaattisen kinetiikan tuotteet. Lähde: Tim Vickers Wikipedian kautta.
Substraattien yleinen yhtälö, entsyymi-substraattikompleksi ja entsymaattisen kinetiikan tuotteet. Lähde: Tim Vickers Wikipedian kautta. Entsyymi (E) yhdistetään substraatin kanssa entsyymi-substraattikompleksin muodostamiseksi K-nopeuksisen vakion kanssa1. E-S-kompleksi voi dissosioitua E: ssä ja S: n reaktionopeuden vakiona k-1.
Samoin kompleksi voi aiheuttaa tuotteen (P) ja entsyymin erottamisen, joka voidaan kierrättää vastaamaan toisen entsymaattisen aktiivisuuden syklin. Tasapainotilanne voidaan saavuttaa valtiolle [on], jossa sen muodostumisnopeus on yhtä suuri kuin sen hajoamisnopeus.
Se voi palvella sinua: luonnolliset kemialliset elementitK -k -1[On] [s] = (k-1 + K -k -2) [On] (1)
Ryhmittely termit ja selvitys [on], sinulla on:
[On] = ([e] [s]) / (k-1 + K -k -2 / K1) (2)
K -k -M = (K-1 + K -k -2) / K1
K -k -M Se on Michaelis.
Michaelis -mente -yhtälön ehdot
Korvaa nyt kM Vuonna (2) jatkamme:
[On] = [e] [s] / kM (3)
Ei -yhdistyneen entsyymin pitoisuus on:
[E] = [ET] - [es] (4)
Missä [e] on vapaa entsyymi ja [eT] Entsyymin kokonaispitoisuus.
Yhdistämällä yhtälöt 3 ja 4, mikä tekee korvauksista erääntyneet ja ottaen huomioon myös VMax, Michaelis-mueeniyhtälö on saavutettu, ilmaistuna seuraavalla tavalla:
V = (vMax [S]) / ([s] + kM-A
Entsymaattisen reaktion suurin nopeus tapahtuu, kun substraattipitoisuus on paljon suurempi kuin kM Ja entsyymien katalyyttiset kohdat on kyllästetty substraatilla. Tämä tapahtuu, kun suhde [s]/[s] + kM Lähestymistavat 1.
Kun [s] on yhtä suuri kuin kM, Yhtälön [S] / [S] + K osaM on yhtä suuri kuin 1/2, mikä osoittaa, että kM Substraatin pitoisuus tuottaa entsymaattisen reaktionopeuden, joka on puolet maksiminopeudesta.
Lisäksi kM Se on substraatin entsyymin affiniteetin mitta: sitä suurempi k: n arvoM, Minor on substraatin entsyymin affiniteetti ja päinvastoin. Siksi K: lleM entsymaattisen reaktion nopeus on alhainen.
Lineweaver-Burk-kuvaaja
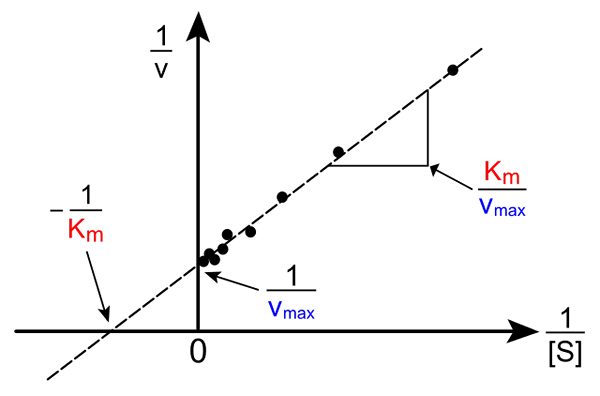 Lineweaver-Burk suoraan. Lähde: Pro Bug Catcher Wikipedian kautta.
Lineweaver-Burk suoraan. Lähde: Pro Bug Catcher Wikipedian kautta. Michaelis-mueeniyhtälön muuntamisella sen käänteisen muodon tuottamiseksi on seuraava muoto:
1/V = (kM / VMax) (1 / [S]) + 1 / VMax
Tämän linjan merkitys on, että sillä on risteys X -akselin kanssa - 1/KM, ja y -akselin kanssa y = 1/vMax (Yläkuva). Linjalla on K -kaltevuusM/Vmax. Tämä sallii tiedon VMax ja kM Nopeuksien käänteisen kääntäminen substraattipitoisuuksien käänteisestä riippuen.
Viitteet
- Strayer, L. (1975). Biokemia. 2antaa Painos. Toimitus palautti.
- Iranin. Levine. (2009). Fysikaalis -periaatteet. Kuudes painos. MC Graw Hill.
- Wikipedia. (2020). Entsyymi -kinetiikka. Haettu: vuonna.Wikipedia.org
- Michael Blaber. (5. kesäkuuta 2019). Entsyymi -kinetiikka. Biologia librettexts. Palautettu: bio.Librettexts.org
- Enyclopaedia Britannica -toimittajat. (2020). Michaelis-Muen-kinetiikka. Toipunut: Britannica.com
- Berg JM, Tymoczko JL, Stryer L. Biokemia. 5. painos. New York: W H Freeman; (2002). Kohta 8.4: Michaelis-malli kuvaa monien entsyymien kineettisiä ominaisuuksia. Palautettu: NCBI.Nlm.NIH.Hallitus

