Sytosiinirakenne, toiminnot, ominaisuudet, synteesi
- 3300
- 484
- Louis Moen
Se Sytosiini Se on pyrimidiinin typpipohja, joka palvelee sytidiini-5'-monofosfaatin ja deksitidiini-5'-monofosfaatin biosynteesiä. Nämä yhdisteet palvelevat vastaavasti biosynteesiä deoksihiobonukleiinihaposta (DNA) ja ribonukleiinihaposta (RNA). DNA tallentaa geneettisen tiedon ja RNA: n toiminnot.
Elävissä olennoissa sytosiinia ei löydy vapaasti, vaan yleensä ribonukleotideja tai deoksihiobonukleotideja. Molemmilla yhdistetyypeillä on fosfaattiryhmä, riboosi ja typpipohja.
 Lähde: Vesprcom [julkinen alue]
Lähde: Vesprcom [julkinen alue] Riboosin hiili 2: lla on oksihydrillo (-OH) -ryhmä ribonukleotideissa ja vetyatomi (-h) deoksiribonukleotideissa. Läsnä olevien fosfaattiryhmien lukumäärästä riippuen on Citidín-5'-monofosfaattia (CMP), Citidín-5'-difosfaattia (CDP) ja Citidín-5'-triffosfaattia (CTP) (CTP).
Desoksisoituja ekvivalentteja kutsutaan desoksicicitidiini-5'-monofosfaatiksi (DCMP), desoksicicitidin-5'-difosfaatiksi (DCDP) ja desoksicicitidin-5'-triffosfaatiksi (DCTP).
Sytosiini osallistuu eri muodoissaan erilaisiin toimintoihin, kuten DNA: n ja RNA: n biosynteesiin, glykoproteiinien biosynteesiin ja geenin ilmentymisen säätelyyn.
[TOC]
Rakenne ja ominaisuudet
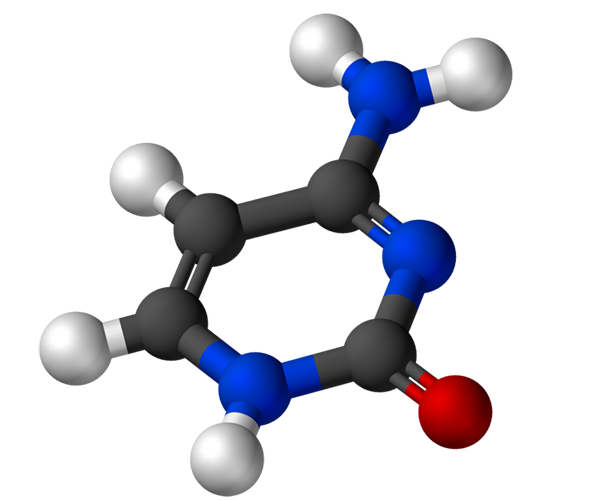
Sytosiinillä, 4-amino-2-hydroksipirimidiinillä, on empiirinen kaava C4H5N3Tai, jonka molekyylipaino on 111,10 g/mol, ja se puhdistetaan valkoisena jauheena.
Sytosiinin rakenne on heterosyklinen, aromaattinen ja tasomainen rengas. Suurin absorbanssiaallonpituus (ʎMax) Se on 260 nm. Sytosiinin fuusiolämpötila ylittää 300 ºC.
Nukleotidin muodostamiseksi sytosiini sitoutuu kovalenttisesti typen kautta 1, keinoin. Hiili 5 'esteröidaan fosfaattiryhmällä.
Biosynteesi
Pyrimidiininukleotidi -biosynteesillä on yleinen reitti, joka koostuu kuudesta askelta, joita katalysoivat entsyymit. Tie alkaa karbamoilifosfaatti-biosynteesillä. Prokaryooteissa on vain yksi entsyymi: Carbamoil -fosfaattisyntaasi. Tämä on vastuussa pyrimidiinien ja glutamiinin synteesistä. Eukaryooteissa on karbamoilifosfaattisyntaasi I ja II, jotka ovat vastaavasti vastuussa glutamiinin ja pyrimidiinin biosynteesistä.
Toinen vaihe koostuu N-karbamoilparhartato-muodostumisesta hiilihiilihiilihyllyn fosfaatista ja aspartaatista, reaktio, jota transpartaatti transcabamoilasa (ATCASA) katalysoituu (ATCASA).
Kolmas vaihe on L-dihydrotoaatin synteesi, joka tuottaa pyrimidiinirenkaan sulkemisen. Tätä vaihetta katalysoi dihydrootaasi.
Neljäs vaihe on orotaton muodostuminen, joka on dihydroorotaatin dehydrogenaasin katalysoima redox -reaktio.
Viides vaihe koostuu substraattina käyttämällä goldylaatin (OMP) fosforibosyylipyrofosfaattia (PRPP) käyttämällä fosforibosyylipyrofosfaattia (PRPP) katalyyttinä katalyyttinä.
Kuudes vaihe on uridilaaton (uridiini-5'-monofosfaatti, UMP) muodostuminen, reaktio, jota katalysoi OMP-dekarboksylaasi.
Se voi palvella sinua: kasvisto ja eläimistö HidalgostaSeuraavat vaiheet koostuvat UMP: n fosforylaatiosta, Kinaasien katalysoimana UTP: n muodostamiseksi ja aminohuryhmän siirtämisestä glutamiinista UTP: hen CTP: n muodostamiseksi, CTP -syntetaasin katalysoima reaktio.
Biosynteesin säätely
Nisäkkäissä säätely tapahtuu karbamoilifosfaattisyntaasissa.
Carbamoil Syntasa II säädetään negatiivisella palautteella. Sen säätelijät, UTP ja PRPP, ovat vastaavasti tämän entsyymin estäjä ja aktivaattori.
Kudoksissa, jotka eivät ole maksa, karbamoilifosfaattisyntaasi II on ainoa karbamoilifosfaatin lähde. Maksassa ollessaan ylimääräisen ammoniakin olosuhteissa karbamoilihäiriöiden fosfaattisyntaasi I tuottaa mitokondrioissa sytosoliin kuljetetun karbamoilifosfaatin, josta se kulkee pyrimidiinien biosynteesin polku.
Toinen säätelypiste on OMP-diskarboksylaasi, jota säätelee kilpailukykyinen esto. Reaktion, UMP, tuote kilpailee OMP: n kanssa sitoutumiskohtaan OMP-descarboxilasa.
Pyrimidiinit, kuten sytosiini, kierrätetään
Pyrimidiinien kierrätyksellä on funktio pyrimidiinien uudelleenkäyttö ilman Novo -biosynteesin tarvetta ja välttää hajoavaa polkua. Kierrätysreaktiota katalysoi fosforibosyylitransferaasi -pyrimidiini. Yleinen reaktio on seuraava:
Pyrimidiini + PRPP -> nukleosidi pyrimidiini 5 '-monofosfaatti + PPI
Selkärankaisilla fosforibosyylitransferaasi -pyrimidiiniä löytyy punasoluista. Tämän entsyymin pyrimidiinien substraatti ovat urasiili, timina ja orotot. Sytosiini kierrätetään epäsuorasti uridiini-5'-monofosfaatista.
Toiminta DNA: n biosynteesissä
DNA: n replikaation aikana DNA: n sisältämät tiedot kopioidaan DNA: sta DNA -polymeraasin läpi.
RNA -biosynteesi tarvitsee deoksynukleotidien tryfosfaattia (DNTP), nimittäin: deksitimidi tryfosfaatti (DTTP), deksitidy -triffosfaatti (DCTP), de -alxyxyadenin tryphyse (datp) ja dexiguaniinin tryfosfaatti (DGTP). Reaktio on:
(DNA)n jätteet + Dntp -> (DNA)N+1 jäte + PPI
Epäorgaaninen pyrofosfaatti (PPI) -hydrolyysi tarjoaa energiaa RNA: n biosynteesille.
Toiminta DNA: n rakenteen stabiloinnissa
Ketjun kaksois -DNUS -helixissä on kytketty vastakkaisen ketjun pyrimidiiniin vety sidoksilla. Siten sytosiini on aina yhteydessä guaniiniin kolmella vety sidoksella: adeniini on kytketty Timiiniin kahdella vety sidoksella.
Se voi palvella sinua: biologian merkitysVety sidokset rikkoutuvat, kun puhdistettu natiivi DNA -liu. Tämä saa kaksinkertaisen DNA -potkurin muodostamaan kaksi erillistä ketjua. Tämä prosessi tunnetaan nimellä denaturoituminen.
Lämpötila, jossa 50% DNA: sta denaturoitu, tunnetaan sulamislämpötilana (TM). DNA -molekyylit, joiden guaniini ja sytosiini.
Yllä oleva on kokeellinen testi, jonka mukaan suurempi määrä vety sidoksia stabiloi paremmin alkuperäiset DNA -molekyylit.
Rikkaiden alueiden toiminta sytosiinissa DNA: ssa
Äskettäin havaittiin, että ihmisen solun ytimen DNA voi omaksua interkaloidut motiivirakenteet (IM). Nämä rakenteet tuotetaan sytosiinialueilla.
IM -rakenne koostuu neljästä DNA -ketjusta, toisin kuin klassinen kaksoispotkurin DNA, jossa on kaksi ketjua. Tarkemmin sanottuna kaksi rinnakkaista dupleksiketjua on välissä antiparallela -suuntauksessa, ja ne ylläpidetään yhdessä hemiprotonoitujen sytosiinien parilla (C: C: C+-A.
Ihmisen genomissa IM -rakenteita löytyy alueilta, kuten promoottoreista ja telomeereistä. IM -rakenteiden lukumäärä on korkeampi solusyklin G1/S -vaiheen aikana, jossa transkriptio on korkea. Nämä alueet ovat proteiinien tunnistuskohtia, jotka osallistuvat transkriptionaalisten koneiden aktivointiin.
Toisaalta alueilla, joissa on runsaasti guaniinipohjia (c) peräkkäisiä, DNA: lla on taipumus omaksua potkurin muodon A kuivumisolosuhteissa. Tämä muoto on tyypillinen RNA: lle ja kaksinkertaiselle DNA-arn-sekoitetulle nauhoille transkription ja replikaation aikana, ja tietyinä aikoina, kun DNA on kytketty proteiiniin.
On osoitettu, että alueet, joilla on peräkkäiset sytosiinimaiset emäkset. Siksi uskotaan, että nämä alueet sitoutuvat proteiineihin, jotka altistavat tietyt geneettisen haurauden genomiset alueet.
Toiminta RNA -biosynteesissä
Transkription aikana DNA: n sisältämät tiedot kopioidaan RNA: ssa pon -polymeraasi -RNA: n kautta. RNA -biosynteesi tarvitsee tryposfaattinukleosideja (NTP), nimittäin: tryphyse -sitrosidiini (CTP), tryposfaatti uridiini (UTP), adeniinin tryposfaatti (ATP) ja tryfosfaatti -guaniini (GTP). Reaktio on:
Voi palvella sinua: Campeche -kasvisto ja eläimistö: edustavat lajit(RNA)n jätteet + NTP -> (RNA)N+1 jäte + PPI
Epäorgaaninen pyrofosfaatti (PPI) -hydrolyysi tarjoaa energiaa RNA: n biosynteesille.
Glykoproteiinien biosynteesissä
Heksaosien peräkkäinen siirto oligosakkaridien, O-ligaattien muodostamiseksi proteiineiksi, tapahtuu nukleotidin esiasteista.
Selkärankaisilla O-ligatoitujen oligosakkaridien biosynteesin viimeinen vaihe koostuu kahden sillihappojätteen (N-asetyylneuramiinin) lisäämisestä citidin-5'-monofosfaatin (CMP) edeltäjästä edeltäjästä edeltäjästä edeltäjältä edeltäjältä (CMP). Tämä reaktio syntyy Golgin transpäsissä.
Sytosiini- ja kemoterapiahoitoja syöpää vastaan
Tetrahydrofolaattihappo (FH4) on ryhmä -CH -lähde3, Ja DTMP: n biosynteesi on välttämätöntä kaatopaikasta. FH2 muodostuu myös. FH2: n pelkistys FH4: lle vaatii folaatin ja NADPH -reduktaasin. Jotkut folaatti reduktaasin estäjiä, kuten aminopteriinia ja metretotrakkeita.
Metotrexan on kilpailukykyinen estäjä. Folaattireduktaasi liittyy 100 kertaa enemmän affiniteettia tähän estäjään kuin sen substraattiin. Aminapteriini toimii samalla tavalla.
Folaattireduktaasin estäminen haittaa epäsuorasti DTMP -biosynteesiä ja siten DCTP: n estämistä. Suora estäminen tapahtuu tihan syntetaasin estäjien kautta, joka katalysoi DTMP: tä kaatopaikasta. Nämä estäjät ovat 5-fluoriurasiili ja 5-fluori-2-dioxiuridiini.
Esimerkiksi 5-fluoraciili ei ole estäjä, vaan ensin tulee kierrätysreitti, deoksiuridi-mofosfaatissa D (FDUMP), joka sitoutuu tkeridilaattisynteesaaseen ja estää sitä.
Glutamiinin, atsaseriinin ja aciviciinin kanssa analogiset aineet estävät amidotransferaasi -glutamiinia. Atsariini oli yksi ensimmäisistä löydetyistä aineista, jotka toimivat itsemurha -inaktivoivana.
Viitteet
- Assi, h.-Lla., Garavís, m., González, c., Ja damha, m.J -. 2018. I-MOTIF-DNA: Solu-biologian rakenteelliset piirteet ja merkitys. Ytimihappotutkimus, 46: 8038-8056.
- Bohinski, r. 1991. Biokemia. Addison-Wesley Iberoamericana, Wilmington, Delaware.
- Devlin, t.M. 2000. Biokemia. Toimitusverkko, Barcelona.
- Loodish, h., Berk, a., Zipurski, S.Lens., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Solu- ja molekyylibiologia. Toimitus Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Meksiko, Sāo Paulo.
- Nelson, D. Lens., Cox, m. M. 2008. Biokemian lehninger-periaatteet. W -.H. Freeman, New York.
- Voet, D. ja Voet, J. 2004. Biokemia. John Wiley ja pojat, USA.

