Kloorihistoria, ominaisuudet, rakenne, riskit, käytöt

- 2630
- 664
- Louis Moen
Hän kloori Se on kemiallinen elementti, jota edustaa CL -symboli. Se on toinen halogeeneistä, jotka sijaitsevat fluorin alapuolella, ja se on myös kolmanneksi kaikkien elektronegatiivisimpi elementti. Hänen nimensä on peräisin sen kellertävästä vihreästä väristä, mikä on voimakkaampaa kuin fluorin.
Yleisesti kun joku kuuntelee nimeään, mikä ensin ajattelee olevan vaatteiden valkaisutuotteita ja uima -altaiden vedessä. Vaikka kloori toimii tehokkaasti sellaisissa esimerkeissä, se ei ole sen kaasu, vaan sen yhdisteet (erityisesti hypokloriitti), jotka käyttävät ja desinfiointiaineen vaikutusta.
 Pyöreä pullo kaasumaisella kloorilla. Lähde: Larenmclane [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Pyöreä pullo kaasumaisella kloorilla. Lähde: Larenmclane [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Yläkuvassa on esitetty pyöreä pullo kaasumaisella kloorilla. Sen tiheys on suurempi kuin ilman tiheä, mikä selittää miksi se pysyy pullossa eikä paeta ilmakehää kohti; Kuten muutkin kevyempien kaasujen kanssa, sanotaan heliumia tai typpeä. Tässä tilassa se on erittäin myrkyllinen aine, koska se tuottaa suolahappoa keuhkoissa.
Siksi perus- tai kaasumainen kloori ei ole liian monta käyttöä, enemmän kuin joissain synteesissä. Sen yhdisteet, joko suolat tai klooratut orgaaniset molekyylit, peittävät kuitenkin hyvän käyttötarjouksen, sijoittamalla äärimmäisen valkoisen uima -altaiden ja vaatteiden ulkopuolelle.
Lisäksi sen atomit kloridianionien muodossa ovat kehomme sisällä, natrium-, kalsium- ja kaliumpitoisuuksien säätäminen sekä mahalaukun mehussa. Jos ei, natriumkloridin saanti olisi vielä tappavampi.
Kloori tapahtuu suolaveden elektrolyysin kautta, runsaasti natriumkloridia, teollisuusprosessia, jossa saadaan myös natrium- ja vetyhydroksidia. Ja koska meret ovat melkein tyhjentämätön tämän suolan lähde, tämän elementin mahdolliset varannot hydrosfäärissä ovat erittäin suuria.
[TOC]
Historia
Ensimmäinen lähestymistapa
Kaasumaisen kloorin korkean reaktiivisuuden vuoksi muinaiset sivilisaatiot eivät koskaan epäileneet niiden olemassaoloa. Heidän yhdisteet olivat kuitenkin osa ihmiskunnan kulttuuria menneisyydestä; Sen historia alkoi liittyä yhteiseen suolaan.
Toisaalta kloori syntyi vulkaanisista purkauksista ja kun joku liukasti kultaa kuninkaalliseen veteen; Mutta mikään näistä ensimmäisistä lähestymistapoista ei ollut tarpeeksi muotoilemaan ajatusta, että tämä kellertävä vihreä kaasu oli yhdistelmäelementti.
Löytö
Kloorin löytäminen johtuu ruotsalaisesta kemisti Carl Wilhelm Scheelestä, joka teki vuonna 1774 reaktion pyrolusiitti mineraalin ja suolahapon (silloin kutsuttuina muriaattihapoksi) välisen reaktion).
Scheele pysyy luottolla, koska hän oli ensimmäinen tutkija, joka tutki kloorin ominaisuuksia; Vaikka Jan Baptist Van Helmont on aiemmin tunnustanut hänet (1630).
Kokeet, joiden kanssa Scheele sai havaintonsa, ovat mielenkiintoisia: hän arvioi kloorin puristuvaa vaikutusta punertavan ja sinertävän kukin kukilla, samoin kuin kasvien ja hyönteisten lehdissä, jotka kuolivat heti.
Hän ilmoitti myös korkeasta reaktiivisestaan metalleihin, tukahduttavaan hajaan ja ei -toivottuun vaikutukseen keuhkoihin ja että kun hän liukenee veteen, hänen happamuutensa lisääntyi.
Oimuriaattinen happo
Siihen mennessä kemikaalit pitivät happoa kaikille niille yhdisteille, joilla oli happea; Joten he jäivät kloorin tulisi olla kaasumainen oksidi. Se oli niin, että he kutsuivat sitä "oksuriaattiseksi happona" (muriaattihapon oksidi), nimen, jonka on luonut kuuluisa ranskalainen kemisti Antoine Lavoisier.
Sitten vuonna 1809 Joseph Louis Gay-Lussac ja Louis Jacques Thénard yrittivät vähentää tätä hiilihappoa; Metallilla saatu reaktio oksideista. Tällä tavoin he halusivat poimia kemiallisen elementin väitetystä oksimuriaattisesta haposta (jota he kutsuivat ”muriaattihapon deflistiseksi ilmaksi '.
Gay-Lussac ja Thénard epäonnistuivat kuitenkin kokeissaan; Mutta ne onnistuivat harkittaessa, että mainitun kellertävän vihreän kaasun tulisi olla kemiallinen elementti eikä yhdiste.
Tunnistus elementtinä
Kloorin tunnustaminen kemialliseksi elementille oli Sir Humphry Davy, joka teki vuonna 1810 omat kokeilunsa hiilielektrodien kanssa ja päätteli, että siellä oli todellakin sellainen muriaattihapon oksidi.
Ja lisäksi Davy loi tämän elementin nimen 'kloori' kreikkalaisesta sanasta 'Chloros', mikä tarkoittaa kellertävää.
Kun he tutkivat kloorin kemiallisia ominaisuuksia, havaittiin, että monilla niiden yhdisteistä oli suolaliuos; Siksi he nimittivät hänet 'halogeeniksi', mikä tarkoittaa myyntimuotosta. Sitten termiä halogeeni käytettiin saman ryhmän muiden elementtien kanssa (F, BR ja I).
Michael Faraday onnistui jopa nesteyttämään2· H2JOMPIKUMPI.
Voi palvella sinua: tehokas ydinkuormaLoput kloorin historia liittyy sen desinfiointiaineen ja valkaisuominaisuuksiin suolaveden elektrolyysin teollisen prosessin kehittämiseen valtavien määrien kloorimäärien tuottamiseksi.
Fysikaaliset ja kemialliset ominaisuudet
Fyysinen ulkonäkö
Se on läpinäkymätön kellertävä vihreä tiheä kaasu, ärsyttävä hehtaarin haju (erittäin tehostettu versio kaupallisesta kloorista) ja on myös erittäin myrkyllinen.
Atominumero (z)
17
Atomipaino
35 45 U.
Ellei toisin ilmoiteta, loput ominaisuudet vastaavat molekyylikloorille mitattuja suuruuksia, cl2.
Kiehumispiste
-34,04 ºC
Sulamispiste
-101,5 ºC
Tiheys
-Normaaleissa olosuhteissa 3,2 g/l
-Vain kiehumispisteessä 1 5624 g/ml
Huomaa, että nestemäinen kloori on noin viisi kertaa enemmän kuin sen kaasu. Myös sen höyryn tiheys on 2,49 kertaa suurempi kuin ilma. Siksi ensimmäisessä kuvassa kloori ei yleensä pääse paeta pyöreästä pullosta, koska tiheämpi kuin ilma sijaitsee taustalla. Tämä ominaisuus tekee edelleen vaarallisemman kaasun.
Sulamislämpö
6 406 kJ/mol
Höyrystyslämpö
20,41 kJ/mol
Molaarinen lämpökapasiteetti
33,95 J/(mol · k)
Vesiliukoisuus
1,46 g/100 ml 0 ºC: ssa
Höyrynpaine
7,67 atm 25 ºC: lla. Tämä paine on suhteellisen alhainen verrattuna muihin kaasuihin.
Elektronegatiivisuus
3.16 Pauling -asteikolla.
Ionisaatioenergiat
-Ensimmäinen: 1251,2 kJ/mol
-Toinen: 2298 kJ/mol
-Kolmas: 3822 kJ/mol
Lämmönjohtokyky
8.9 · 10-3 W/(m · k)
Isotoopit
Klooria esiintyy luonnossa ensisijaisesti kahtena isotooppina: 35CL, runsaasti 76%ja 37CL, runsaasti 24%. Siten atomipaino (35,45 U) on näiden kahden isotoopin atomisimassa keskiarvo, niiden vastaavuusprosentit ovat runsaasti.
Kaikki klooriradioisotoopit ovat keinotekoisia, joista 36CL on vakain, puoli -elämä 300 000 vuotta.
Hapetusluvut
Kloorilla voi olla useita lukuja tai hapetustiloita, kun se on osa yhdistettä. Koska se on yksi jaksollisen taulukon elektronegatiivisimmista atomeista, sillä on yleensä negatiiviset hapettumisluvut; Lukuun ottamatta silloin, kun se toimii hapen tai fluorin kanssa, joiden oksidit ja fluoridit, sen on "kadotettava" elektroneja.
Sen hapettumislukujen oletetaan, että ionien olemassaolo tai läsnäolo samalla kuormituksella oletetaan. Siten meillä on: -1 (cl-, Kuuluisa kloridianioni), +1 (CL+), +2 (Cl2+), +3 (Cl3+), +4 (Cl4+), +5 (Cl5+), +6 (Cl6+) ja +7 (cl7+-A. Kaikista -1, +1, +3, +5 ja +7 ovat yleisimpiä löydettyjä kloorattuja yhdisteitä.
Esimerkkejä varten CLF: ssä ja CLF: ssä3 Kloorin hapetusluvut ovat +1 (Cl+F-) ja +3 (cl3+F3--A. CL: ssä2Tai tämä on +1 (cl2+JOMPIKUMPI2-) ollessa CLO: ssa2, Cl2JOMPIKUMPI3 ja cl2JOMPIKUMPI7, Poika +4 (cl4+JOMPIKUMPI22-), +3 (Cl23+JOMPIKUMPI32-) ja +7 (cl27+JOMPIKUMPI72--A.
Kaikissa klorideissa, toisaalta kloorin hapettumismäärä -1; Kuten NaCl (na+Cl-), Missä on pätevä sanoa, että CL on olemassa- Kun otetaan huomioon tämän suolan ioninen luonne.
Elektroninen rakenne ja kokoonpano
Kloorimolekyyli
 Diatominen kloorimolekyyli, jota edustaa avaruustäyttömalli. Lähde: Benjah-BMM27 Wikipedian kautta.
Diatominen kloorimolekyyli, jota edustaa avaruustäyttömalli. Lähde: Benjah-BMM27 Wikipedian kautta. Klooriatomilla niiden perustilassa on seuraava elektroninen kokoonpano:
[Ne] 3s2 3P5
Siksi jokaisella heistä on seitsemän Valencian elektronia. Ellei niitä ole ylikuormitettu energialla, avaruudessa on yksittäisiä atomeja, ikään kuin ne olisivat vihreitä marmoreja. Hänen luonnollinen taipumuksensa on kuitenkin muodostaa kovalenttisia sidoksia niiden välillä Valencian oktettinsa loppuun saattamiseksi.
Huomaa, että he tuskin tarvitsevat elektronia kahdeksan valenssielektronia, joten ne muodostavat yhden yksinkertaisen linkin; Tämä on se, joka liittyy kahteen CL -atomiin CL -molekyylin luomiseksi2 (Yläkuva), Cl-Cl. Siksi kloori normaaleissa ja/tai maanpäällisissä olosuhteissa on molekyylikaasu; ei -hermoominen, kuten jalokaasujen tapauksessa.
Molekyylien väliset vuorovaikutukset
Molekyyli Cl2 Se on homonukleaarinen ja apolaarinen, joten sen molekyylien välisiä vuorovaikutuksia säätelevät Lontoon dispersiovoimat ja sen molekyylimassat. Soda -faasissa etäisyys cl2-Cl2 Se on suhteellisen lyhyt verrattuna muihin kaasuihin, jotka lisäsivät sen massan, tekee siitä kaasun kolme kertaa enemmän kuin ilma.
Valo voi herättää ja edistää elektronisia siirtymiä CL: n molekyylin kiertoradalla2; Näin ollen sen tyypillinen kellertävä vihreä väri ilmestyy. Tämä väri lisääntyy nestetilassa ja katoaa sitten osittain, kun se jähmettyy.
Voi palvella sinua: Heikot perusteetLämpötilan laskeutuessa (-34 ºC), CL-molekyylit2 Ne menettävät kineettisen energian ja etäisyyden Cl2-Cl2 vähenee; Siksi ne yhtenäiset ja lopulta määrittelevät nestemäisen kloorin. Sama tapahtuu, kun järjestelmä (-101 ºC) jäähdytetään edelleen, nyt CL-molekyyleillä2 Niin yhdessä, joka määrittelee ortorromisen kristallin.
Se tosiasia, että kloorikiteitä on, on osoitus siitä, että niiden dispergoivat voimat ovat riittävän suuntaisia rakenteellisen kuvion luomiseksi; Tämä on molekyylikerrokset Cl2. Näiden kerrosten erottaminen on sellaista, että jopa 64 GPA: n paineessa sen rakennetta muutetaan, eikä niillä ole sähköjohtoavia.
Missä se on ja saa
Kloridisuolat
 Halitan vankat kiteet, tunnetaan paremmin nimellä tavallinen tai pöytäsuola. Lähde: Vanhempi Géry [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Halitan vankat kiteet, tunnetaan paremmin nimellä tavallinen tai pöytäsuola. Lähde: Vanhempi Géry [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Kloori sen kaasumaisessa tilassa ei löydy mistään maan pinnalta, koska se on hyvin reaktiivinen ja yleensä muodostaa klorideja. Nämä kloridit ovat hyvin leviämässä koko maankuoreen, ja myös miljoonien vuosien ajan sateiden vetämisen jälkeen meret ja valtameret rikastuttavat.
Kaikista klorideista NaCl del Mineral Halita (ylivoimainen kuva) on yleisin ja runsas; Seuraavat Silvina, KCL ja Carnalita, MGCL -mineraalit2· Kcl · 6H2JOMPIKUMPI. Kun vesimassat haihtuvat auringon vaikutuksesta jättäen autiomaasuolajärvien taakse, josta NaCl voidaan erottaa suoraan kloorin raaka -aineena.
Suolaveden elektrolyysi
NaCl liukenee veteen suolaveden tuottamiseksi (26%), jolle elektrolyysi altistetaan kloralkaliinisoluksi. Anodissa ja katodiosastoissa tapahtuu kaksi puoliarviketta:
2CL-(Ac) => cl2(g) + 2e- (Anodi)
2H2Tai (l) + 2e- => 2OH-(AC) + H2(g) (katodi)
Ja molempien reaktioiden globaali yhtälö on:
2nacl (ac) + 2h2Tai (l) => 2NAOH (AC) + H2(g) + cl2(g)
Kun reaktio tapahtuu, Na -ionit+ Anodissa, jotka he siirtyvät katodilokeroon, joka ylittää läpäisevän asbestikalvon. Tästä syystä NaOH on globaalin yhtälön oikealla puolella. Molemmat kaasut, Cl2 ja h2, Ne kerätään vastaavasti anodista ja katodista.
Alempi kuva kuvaa uutta kirjoitettua:
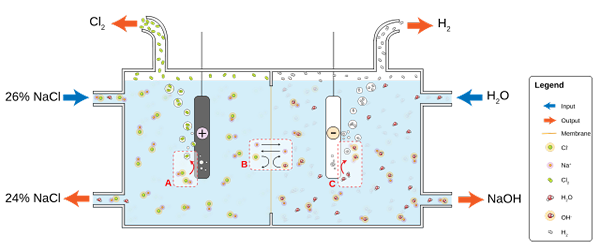 Kaavio kloorin tuotantoon suolaveden elektrolyysin avulla. Lähde: JKWCHUI [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Kaavio kloorin tuotantoon suolaveden elektrolyysin avulla. Lähde: JKWCHUI [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Huomaa, että suolaveden pitoisuus lopussa laskee 2% (se nousee 24: stä 26%: iin), mikä tarkoittaa sitä osaa sen CL: stä- Alkuperäiset muuttuivat CL -molekyyleiksi2. Lopulta tämän prosessin teollistuminen on myöntänyt menetelmän kloorin, vedyn ja natriumhydroksidin tuottamiseksi.
Pyrolusiitin happama liukeneminen
Kuten historiaosassa mainittiin, kaasumaista klooria voidaan tuottaa liukenemalla näytteitä pyrolusiittimalmista suolahapolla. Seuraava kemiallinen yhtälö näyttää reaktiosta saadut tuotteet:
Mne2(S) + 4HCL (AC) => MCL2(AC) + 2H2Tai (l) + cl2(g)
Seokset
Kahden yksinkertaisesta syystä ei ole klooriseoksia: niiden kaasumaisia molekyylejä ei voida loukkuun metallikiteiden keskuudessa, ja nämä ovat myös erittäin reaktiivisia, joten ne reagoivat välittömästi metallien kanssa vastaavan kloridin tuottamiseksi.
Toisaalta kloridit eivät ole myöskään toivottavia, koska veteen liuentumisen jälkeen niillä on suolaliuosvaikutus, joka edistää seoksissa korroosiota; Ja siksi metallit liukenevat muodostamaan metalliklorideja. Kunkin seoksen korroosioprosessi on erilainen; Jotkut ovat alttiimpia kuin toiset.
Kloori ei siis ole hyvä lisäaine seoksille; eikä Cl2 eikä pidä cl- (Ja atomit olisivat hyvin reaktiivisia, jotta ne voivat jopa olla).
Riskejä
Vaikka kloorin liukoisuus veteen on alhainen, se riittää tuottamaan ihomme kosteudessa ja silmissä suolahappoa, joka lopulta syövyttäen kudoksia aiheuttaen vakavia ärsytyksiä ja jopa näköhäviöitä.
Vielä pahempaa on hengittää kellertävän vihertäviä höyryään, koska keuhkoissa se taas tuottaa hapoja ja vahingoittaa keuhkokudoksen. Tämän kanssa henkilö kokee kurkkukipuja, yskää ja hengitysvaikeuksia keuhkoihin muodostuneiden nesteiden takia.
Jos kloori on paeta, se kohtaa erityisen vaarallisen tilanteen: ilma ei voi yksinkertaisesti "pyyhkäistä" höyrynsä; Pysy siellä, kunnes he reagoivat tai leviävät hitaasti.
Voi palvella sinua: Precision Balance: Ominaisuudet, toiminnot, osat, käyttötarkoituksetTämän lisäksi se on erittäin hapettava yhdiste, joten useat aineet voivat reagoida räjähtävästi hänen kanssaan pienimpaan kosketukseen; Kuten teräsvilla ja alumiini. Siksi missä on varastoitu kloori, on otettava kaikki tarvittavat näkökohdat paloharssien välttämiseksi.
Ironista kyllä, vaikka kaasumainen kloori on tappava, sen kloridianioni ei ole myrkyllinen; Se voidaan kuluttaa (maltillisesti), ei polta tai reagoida paitsi fluoridilla ja muilla reagensseilla.
Sovellukset
Synteesi
Noin 81 % vuosittain tuotetusta kaasumaisesta kloorista on tarkoitettu orgaanisten ja epäorgaanisten kloridien synteesiin. Näiden yhdisteiden kovalenssi-asteesta riippuen klooria voidaan löytää pelkkinä CL-atomeina kloorattuissa orgaanisissa molekyyleissä (C-C-sidoksilla) tai CL-ioneina- Muutamassa kloridisuolossa (NaCl, CACL2, Mgcl2, jne.-A.
Jokaisella näistä yhdisteistä on omat sovelluksensa. Esimerkiksi kloroformi (CHCL3) ja etyylikloridi (CH3CH2Cl) ovat liuotin, joita on tullut käytetty hengitysanestesetiikkana; Dikloorometano (ch2Cl2) ja hiilitetrakloridi (CCL4), Omasta puolestaan niitä käytetään laajasti orgaanisissa kemian laboratorioissa.
Kun nämä klooratut yhdisteet ovat nestemäisiä, suurimman osan ajasta ne on tarkoitettu orgaanisten reaktioiden liuottimiksi.
Muissa yhdisteissä klooriatomien läsnäolo edustaa lisääntymistä dipolimomentissa, joten ne voivat olla vuorovaikutuksessa suuremmassa määrin polaarisen matriisin kanssa; proteiinien, aminohappojen, nukleiinihapojen jne. Muotoilevat., biomolekyylit. Siten kloorilla on myös paperia lääkkeiden, torjunta -aineiden, hyönteismyrkkyjen, sienitautien jne. Synteesissä, jne.
Epäorgaanisten kloridien suhteen niitä käytetään yleensä katalyytteinä, raaka -aineiden saamiseksi elektrolyysillä tai Cl -ionilähteillä-.
Biologinen
Kaasumaisella tai alkukloorilla ei ole roolia elävissä olennoissa enemmän kuin heidän kudosten tuhoaminen. Tämä ei kuitenkaan tarkoita, että niiden atomia ei löydy kehosta. Esimerkiksi Cl -ionit- Ne ovat erittäin runsaasti solu- ja solunulkoisessa väliaineessa ja auttavat hallitsemaan Na -ionitasoja+ ja CA2+, enimmäkseen.
Samoin suolahappo on osa mahalaukun mehua, jonka kanssa ruoka sulautuu vatsaan; sen Cl -ionit-, H: n seurassa3JOMPIKUMPI+, Määritä pH lähellä yhtä näistä erityksistä.
Kemikaaliset aseet
Kaasumaisen kloorin tiheys tekee siitä tappavan aineen, kun se vuotaa tai kaadetaan suljettuihin tai avoimiin tiloihin. Koska se on tiheämpi kuin ilma, sen virta ei vedä helposti klooria, joten se pysyy huomattavasti ennen kuin lopulta leviäminen.
Esimerkiksi ensimmäisessä maailmansodassa tätä klooria käytettiin taistelukentällä. Kun hän vapautettiin, hän hiipi kaivoihin tukahduttaakseen sotilaat ja pakottamaan heidät menemään pintaan.
Desinfiointiaine
 Uima -altaat kloronisoidaan mikro -organismien lisääntymisen ja leviämisen välttämiseksi. Lähde: Pixabay.
Uima -altaat kloronisoidaan mikro -organismien lisääntymisen ja leviämisen välttämiseksi. Lähde: Pixabay. Kloronisoiduilla liuoksilla, joissa kaasumainen kloori on liuennut veteen ja sitten alkalisoituvat puskurilla, on erinomaiset desinfiointiaineet, samoin kuin estävät kudosten mätää. Niitä on käytetty avoimien haavojen desinfiointiin patogeenisten bakteerien poistamiseksi.
Allasvesi kloorisoidaan tarkasti bakteerien, mikrobien ja loisten poistamiseksi, jotka voivat sijoittaa sen. Tätä tarkoitusta varten käytettiin kaasumaista klooria, mutta sen vaikutus on melko aggressiivinen. Sen sijaan käytetään natriumhypokloriittiliuoksia (valkaisuaine) tai triklooroisoosianuriinihappoa (ATC) (ATC).
Edellä oleva osoittaa, että se ei ole CL2 Se, joka käyttää desinfiointiainetta, mutta HCLO, hypokloriitihappo, joka tuottaa radikaaleja tai ·, joka tuhoaa mikro -organismit.
Valkaisu
Hyvin samanlainen kuin sen desinfiointiaineen toiminta, kloori myös valkaisee materiaaleja, koska HCLO: sta vastaavat värit. Siten sen kloronisoidut liuokset ovat ihanteellisia pisteiden poistamiseksi valkoisista vaatteista tai valkaisuaineiden massaan.
Polyvinyylikloridi
Kaiken tärkein kloorattu yhdiste, jolle noin 19% kaasumaisen kloorin jäljellä olevasta tuotannosta on osoitettu, on vinyylipolykloridi (PVC). Tällä muovilla on useita käyttötarkoituksia. Sen kanssa valmistetaan vesiputkia, ikkunoiden kehykset, seinät ja lattiat, sähköjohdot, laskimonsisäiset pussit, takit jne.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). Kloori. Haettu: vuonna.Wikipedia.org
- Laura H. et al. (2018). Kiinteän kloorin rakenne 1: ssä.45 gpazetschrift für Kristallgraphie. Kristallimateriaalit, osa 234, numero 4, sivut 277-280, ISSN (online) 2196-7105, ISSN (painettu) 2194-4946, doi: doi.org/10.1515/ZKRI-2018-2145
- Kansallinen bioteknologiatietojen keskus. (2019). Kloori. Pubchem -tietokanta. CID = 24526. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Marques Miguel. (S.F.-A. Kloori. Toipunut: Nautilus.Fis.UC.Pt
- Amerikan kemianeuvosto. (2019). Kloorikemia: Johdanto klooriin. Toipunut: kloori.Amerikkalainen.com
- Fong-yan ma. (S.F.-A. Kloridien syövyttävät vaikutukset metalleihin. Marine Engineering Laitos, Kiinan NTOU -tasavalta (Taiwan).
- New Yorkin osavaltio. (2019). Klooria koskevat tosiasiat. Toipunut: terveys.Ny.Hallitus
- DR. Doug Stewart. (2019). Kloorielementti. Kemikooli. Toipunut: Chemicool.com

