Coulombimetrian perusteet, tyypit, sovellukset

- 735
- 45
- Juan Breitenberg V
Se Coulombimetria Se on sähkökemiallinen analyysitekniikka, joka koostuu tyhjentävän elektrolyysin suorittamisesta, jotta analyytti voidaan määrittää; toisin sanoen analyytin pitoisuuden määrittäminen ongelmien ongelmiin sen täydellisen hapettumisen tai vähentämisen kautta. Se on toisin kuin potentiometria, dynaaminen tekniikka, koska virran annetaan virtata vapaasti sähkökemiallisten solujen läpi.
Kuten nimensä viittaa, sähkövaraus Q, Coulomb -yksiköissä, C, mitataan ja korreloi hapettuneen tai pelkistetyn analyytin pitoisuuden kanssa elektrodin reuna -alueilla. Siksi analyytin muutoksen hapetustilat, jotka tapahtuvat prosessissa A elektronien siirto ja imeytyminen, mikä mahdollistaa halutun pitoisuuden stökiometrisen laskennan.
 Alkeellinen kokoonpano elektrolyysille, jossa muodostuu useita värikkäitä lajeja, jotka johtuvat läsnä olevien metsänhoitajien kompleksoinnista. Lähde: Steve Jurvetson Menlo Parkista, USA, CC 2.0, Wikimedia Commons
Alkeellinen kokoonpano elektrolyysille, jossa muodostuu useita värikkäitä lajeja, jotka johtuvat läsnä olevien metsänhoitajien kompleksoinnista. Lähde: Steve Jurvetson Menlo Parkista, USA, CC 2.0, Wikimedia Commons Coulombimetriassa akkua tai potentiostattia käytetään soluihin käytetyn virran tai potentiaalin hallintaan. Nämä solut, toisin kuin potentiometriset solut, koostuvat kolmielektrodijärjestelmästä, ja ne on varustettu volttimittarilla ja ampeerimittarilla.
Coulombimetriassa on etu, että pystyt suorittamaan asteet valmistelematta tai standardisoimalla malleja. Se mahdollistaa myös erittäin pienten ja rajoitetun määrän analyytin, kuten metallikationien, epäorgaanisten yhdisteiden ja orgaanisten yhdisteiden, kvantifiointia. Esimerkiksi, on suunniteltu yksinomaan CO: n mittaamiseen tarkoitettu coulometri2 liuennut näytteisiin merestä.
Tämä tekniikka tarjoaa erilaisen analyyttisen reitin kuin tilavuus- ja potentiometrinen, niin monet analyysit, analyytin sähkökemiallisesta luonteesta riippuen, voi kehittää coulombimetrisesti.
Coulombimetrian teoreettiset perusteet
Faradayn laki
Coulombimetria perustuu Faradayn lakiin, joka muodostaa suhteen sähkökemiallisen solun sähkövarauksen ja hapettavan tai pelkistävän analyytin määrän välillä. Tietäen tämän kuorman q, samoin kuin elektronin kuorma (1.6 · 10-19 C), voit laskea reaktioon osallistuvien elektronien lukumäärän, nja--
nja- = Q/e
Toisaalta tiedetään, että yksi elektronien mooli (6.02 · 1023) Porta Sähkövaraus, joka on yhtä suuri kuin 96485 C, Faraday -vakiona kutsuttu luku:
F = sisään-Lla
= 96485.3365 c/mol
On kätevä ilmaista elektronien määrä moolista riippuen. Tämän ansiosta voidaan käyttää sähkökemiallisen reaktion stökiometrisiä kertoimia, olla hapettuminen tai pelkistys ottaen huomioon.
Voi palvella sinua: Natriumfosfaatti: rakenne, ominaisuudet, synteesi, käyttääPeruslaskelmat
Tarkastele esimerkiksi seuraavaa kemiallista yhtälöä:
Härkä + 2e- → Verkko
Mittaamalla, että kun koko OX -laji on pelkistetty verkkoon, voimme laskea OX: n moolit muuntokertoimilla:
xq · (mol e- /96485.3365 c) · (mol härkä/ 2mol e-) = mol härkä
Eli kuten tiedämme sähkövarauksen elektronien moolille, meillä on kuinka monta elektronia vastaa kuormaa XQ. Mutta puolestaan jokaista näiden elektronien kahta moolia käytetään 1 mol härän hapettamiseen.
Tämä päättely aiheuttaa suoran kaavan, vaikka sitä ei suositella muistamaan, vaan pystyä päättämään se sellaisena kuin se tehtiin:
n = Q/(fñja--A
Missä ñja- Se on elektronien moolien lukumäärä kemiallisessa yhtälössä.
Edellyttäen, että se voidaan laskea Q, riippumatta coulombimetrian tyypistä, Ox- tai verkkoanalyytin moolit voidaan määrittää; Niin kauan kuin virran tehokkuus on 100%. Jälkimmäinen tarkoittaa, että kaikki kuormitus, jonka on oltava vain yhden muutoksen tuote, ilman että muut lajit vähennetään tai hapettuu.
Coulombimetrian kokeelliset perusteet
Solut
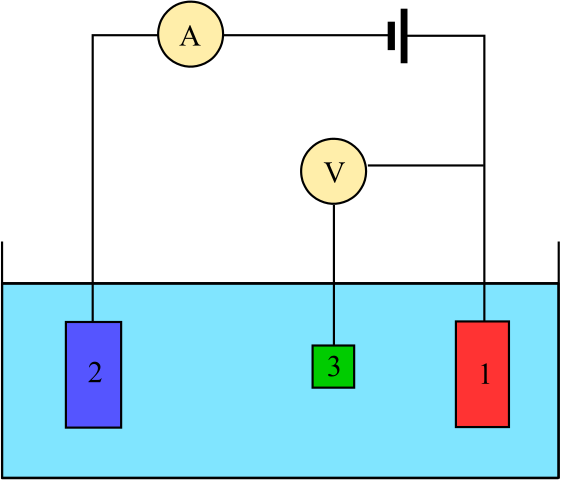 Kaavio sähkökemialliselle kennolle, joka koostuu kolmesta elektrodista: viite (3), avustaja (2) ja työ (1) (1). Lähde: Adam Rędzikowski, CC BY-SA 3.0, Wikimedia Commons
Kaavio sähkökemialliselle kennolle, joka koostuu kolmesta elektrodista: viite (3), avustaja (2) ja työ (1) (1). Lähde: Adam Rędzikowski, CC BY-SA 3.0, Wikimedia Commons Ylös meillä on kaavio solulle, jolla on kolme elektrodia, jota käytetään yleisesti coulombimetrisissä analyyseissä. Redox -reaktio tapahtuu työelektrodien (1) ja apulaitteiden keskuudessa (2). Niistä kaksi on kytketty akku, jotta voidaan käyttää potentiaalia soluun ja ampeerimittari (A) sähkövirtojen mittaamiseksi.
Vertailuelektrodia (3) tarvitaan kuitenkin työelektrodin potentiaalin seuraamiseksi ja siten tuntemaan apuelektrodin potentiaalin vaihtelu. Tällä tavalla koko solun potentiaali voidaan määrittää jasolu, välttämätön redox -reaktioiden päättymisen arvioimiseksi yhdessä coulombimetrian tyypissä.
Huomaa, että työelektrodin ja vertailuelektrodin välillä ei melkein virtaa virtaa korkean impedanssin volttimittarin (V) vuoksi, jonka ansiosta työelektrodin potentiaali lukee potentiaalin. Näiden kahden elektrodin välillä meillä on samanlainen järjestelmä kuin potentiometrinen analyysi: se on staattinen eikä dynaaminen.
Se voi palvella sinua: ydinkemia: historia, opintokenttä, alueet, sovelluksetPotentiaalinen
Coulombimetria on niin sanotusti elektrolyysi, joka suoritetaan analyyttisiä ja kvantitatiivisia tarkoituksia varten. Siksi puhuu ulkoisten potentiaalien, jotka ovat akun tarjoamia, soveltamisesta ei -spontaanien sähkökemiallisten reaktioiden suorittamiseksi; eli ne, joilla on negatiivisia potentiaaleja.
Harkitse esimerkiksi seuraavia reaktioita, joihin liittyy heidän potentiaalisia standardeja:
Cu2+ + 2e- ⇌ cu (s) eºruudukko = +0.337 V
H2Tai ⇌ 1/2o2(g) + 2h+ + 2e- Eºruudukko = +1.230 V
On globaalin reaktion yhtälö, joka on yhtä suuri kuin:
Cu2+ + H2Tai ⇌ cu (s) + 1/2o2(g) + 2h+ Eºruudukko = -0.893 V
Akun on käytettävä 0,.893 V niin, että kuparielektrodi ja vetyionien muodostuminen on mahdollista. Tämä potentiaali on Esolu. Käytännössä on kuitenkin käytettävä potentiaalia, joka on suurempi kuin laskettu, koska on potentiaalia, jotka vastustavat reaktion kehitystä:
JAsolu = Ekatodi - JAanodi - OP - IR - CP
Missä,
OP: Ylipotentiaali (kineettinen este)
IR: Ohminen (solujen luontainen potentiaali)
CP: pitoisuuksien polarisaatio (CU: n laskujen tuote2+-A
Tyypit coulombimetria
Coulombimetriaa on kolme tyyppiä: ampeerostaattinen, potentiostaattinen ja elektrografinen elektrogravimetrinen.
Amperostaattinen tai galvantaattinen
Tämän tyyppisessä coulombimetriassa solun läpi kulkeva virta on vakio käyttämällä ampeeriasta. Siksi virran ollessa Yllyttää Ammerimittarin lukemisen ansiosta ja myös ajan tietäminen t Kun elektrolyysi päättyy, voimme laskea analyytin muunnokseen liittyvän kuorman:
Q = Esine
Nykyisen vakion pitämisen seurauksena on, että elektrodit potentiaaliset muutokset joko positiivisesti tai negatiivisesti. Tämä äkillinen variaatio on osoitus siitä, että analyytti on reagoinut kokonaan, eli silloin, kun elektrolyysi pysähtyy ja mitataan t. Tämä on perusta coulometrisille asteille.
Jos potentiaali jatkuu tai latautuu, muut ei -toivotut elektroaktiiviset lajit lopulta reagoivat. Siksi kiinnostaviin muutoksiin liittyvät potentiaalit tulisi tunneta täydellisesti.
Potentiostaattinen
Yksi tapa estää muita lajeja. Täällä on potentioottinen coulombimetria. Toisin kuin amperostaattinen coulombimetria, nyt muuttuu ajan myötä.
Voi palvella sinua: Tolueeeni: rakenne, ominaisuudet, käytöt, hankkiminenTämän teknisen kokoonpanon vuoksi emme voi laskea sitä suoraan arvojen kanssa Yllyttää ja t; Nykyinen vähenee ajan myötä. Tämä johtuu siitä, että analyytin reagointiin on vähemmän ja vähemmän molekyylejä tai atomeja, jotka luovuttavat tai hyväksyvät elektroneja. Siksi, mikä on yhtä suuri kuin kiinteä alue grafiikkakäyrän alla Yllyttää vs t.
Elektrografinen
Elektrografinen coulombimetria, jota kutsutaan yksinkertaisesti elektrogravimetriaksi, on elektrolyysi, jossa ei ole tarpeen mitata kuormia tai sähkövirtoja. Sen sijaan elektrodien massat mitataan ennen elektrolyysiä ja sen jälkeen.
Tämä tekniikka pätee vain silloin, kun vähennetyt lajit ovat metallikationeja, jotka ovat elektrodeposeja elektrodeissa, mikä tekee niistä raskaampia.
Sovellukset
Potentiosttinen
Potentiostiset analyysit mahdollistavat selektiivisesti yhden lajin vähentämisen tai hapettamisen seoksen keskellä. Esimerkiksi niitä käytetään seuraavien epäorgaanisten ionien pitoisuuden määrittämiseen jälkimäärissä tai monimutkaisissa matriiseissa:
-Cu2+
-Ässä3+
-CD2+
-Yhteistyö2+
-Usko2+ ja usko3+
-Pb2+
-X (f-, Cl-, Br- ja minä--A
-Ei kumpikaan2+
-Puku3+
-Ag+
-Sn2+
-Zn2+
-TAI6+
Näitä analyysejä voidaan myös käyttää seoksen koostumuksen määrittämiseen. Kun happoseos on liuennut, solupotentiaalit levitetään porrastetulla ja kontrolloidulla tavalla, määrittäen siten vähentyneen määrän jokaiselle sen integroivalle metallikationille.
Coulometriset asteet
Käytetään coulometrisissä asteissa välittäjäaineita, jotka varmistavat neutraloida kokonaan tai reagoida jäljellä olevan analyytin kanssa. Tämän tarkoituksena on estää mahdolliset variaatiot vakiovirtaan, johdetaan vakuusreaktioissa. Siten se on mahdollista haltija, esimerkiksi askorbiinihappo käyttämällä jodia välittäjänä.
Jotkut metallikationit, kuten AG+, EY3+, Usko3+, Mn2+, Sinä3+, Cr2+, Ne voidaan määrittää myös näillä asteilla.
Toisaalta happo-emäsreaktiot voivat edelleen käyttää tätä tekniikkaa, koska suuret potentiaalit aiheuttavat vettä ioniseksi3JOMPIKUMPI+ tai tai oh-, jotka palvelevat nimikkeen edustajia, jotka syntyvät in situ; Eli ne neutraloivat hapot tai läsnä olevat emäkset.
Yhteistyökumppani2 valtameren saostumisreaktiot ja kompleksien muodostuminen EDTA: n kanssa on myös mahdollista analysoida niitä soveltamalla coulometrisiä asteita, joissa lisätään redox -indikaattoreita korostamaan elektrolyysin viimeistä pistettä,.
Viitteet
- Päivä, r., & Underwood, a. (1986). Kvantitatiivinen analyyttinen kemia (Viides ed.-A. Pearson Prentice Hall.
- Skoog d.-Lla., Länsi D.M. (1986). Instrumentaalianalyysi. (Toinen Ed.-A. Amerikkalainen., Meksiko.
- DR. Doug Stewart. (2020). Määritelmä coulometria. Toipunut: Chemicool.com
- Wikipedia. (2020). Coulometria. Haettu: vuonna.Wikipedia.org
- Harvey David. (5. kesäkuuta 2019). Coulometriset menetelmät. Kemian librettexts. Palautettu: Chem.Librettexts.org
- « Metodologinen kehys kuinka kirjoittaa, rakenne, esimerkkejä
- Nykyaikainen filosofian alkuperä, ominaispiirteet, virrat, kirjoittajat »

