Kromi (CR)

- 2114
- 475
- Gustavo Runte DVM
 Chrome on erittäin reaktiivinen metalli. Wikimedia Commons
Chrome on erittäin reaktiivinen metalli. Wikimedia Commons Mikä on kromi?
Hän kromi (CR) on jaksollisen taulukon ryhmän 6 (VIB) kemiallinen elementti. Vuosittain tonnia tätä metallia tuotetaan uuttamalla kromiitti- tai magnesium -mineraalit (FOCR2JOMPIKUMPI4, Mgcr2JOMPIKUMPI4), jotka pelkistetään hiilellä metallin saamiseksi. Se on hyvin reaktiivinen, ja vain hyvin pelkistävissä olosuhteissa se on puhtaassa muodossaan.
Sen mineraalit ja oksidit, samoin kuin pieni metallinen kupariosa, tekevät tästä elementistä miehittämään maan 22, joka on runsaimmalla maapallon aivokuorella.
Kromikemia on hyvin monipuolinen, koska se voi muodostaa yhteyksiä melkein koko ajanjakson taulukkoon. Jokaisella sen yhdisteellä on värejä, jotka riippuvat hapetusmäärästä, samoin kuin sen kanssa vuorovaikutuksessa olevista lajeista.
Myös muodostavat yhteydet hiileen, puuttuen suureen määrään organimetaalisia yhdisteitä.
Kromin ominaisuudet ja ominaisuudet
Kromi on puhtaassa muodossa hopeametalli, atomiluku 24 ja molekyylipaino on noin 52 g/mol (52Cr, sen vakain isotooppi).
Vahvojen metallilinkkiensä vuoksi se esittelee fuusiopisteitä (1907 ºC) ja kiehumisen (2671 ºC) korkea. Lisäksi sen kiteinen rakenne tekee siitä erittäin tiheän metallin (7.19 g/ml).
Se ei reagoi veden kanssa hydroksidien muodostamiseksi, vaan happojen kanssa. Se hapettuu ilman hapen kanssa, joka yleensä tuottaa kromioksidia, joka on laajalti käytetty vihreä pigmentti.
Nämä oksidikerrokset luovat niin kutsutun Passivointi, Suojaa metallia seuraavilta korroosioilta, koska happi ei pääse tunkeutumaan metalliin.
Sen elektroninen kokoonpano on [AR] 4S13D5, Kaikilla puuttuvilla elektroneilla, ja siksi sillä on paramagneettisia ominaisuuksia. Elektronisten pyörien pariutuminen voi kuitenkin tapahtua, jos metallia altistetaan matalille lämpötiloille, jolloin saadaan muita ominaisuuksia, kuten antiferromagnetismi.
Voi palvella sinua: tulenkestävä materiaaliKemiallinen kromirakenne
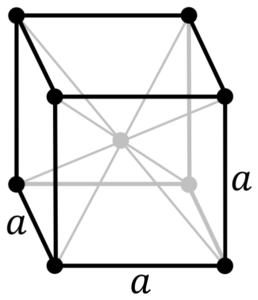 Kromimetallirakenne. Lähde: Alkuperäiset PNG: t kirjoittanut Daniel Mayer, Drbob, Wikimedia Commons
Kromimetallirakenne. Lähde: Alkuperäiset PNG: t kirjoittanut Daniel Mayer, Drbob, Wikimedia Commons Mikä on kromimetallin rakenne? Kromi käyttää puhtaassa muodossaan kuutiomaisen kiteisen rakenteen, joka on keskittynyt runkoon (CC tai BCC). Tämä tarkoittaa, että kromiatomi sijaitsee kuution keskellä, jonka reunat ovat muiden kromien miehittämät (kuten ylemmässä kuvassa).
Tämä rakenne on vastuussa Chromesta, jolla on korkeat sulamis- ja kiehumispisteet sekä suuri kovuus. Kupariatomit ovat päällekkäisiä S- ja D -orbitaaliensa muodostamiseksi ajokaistojen muodostamiseksi bänditeorian mukaan.
Siten molemmat kaistat ovat täynnä puoleen, koska niiden elektroninen kokoonpano on [AR] 4S13D5, Ja kiertoradalla voi olla kaksi elektronia ja kymmenen kiertorataa. Sitten vain puolet niiden päällekkäisyyksistä muodostuneista nauhoista miehittää elektronit.
Näillä kahdella näkökulmalla -kiteinen rakenne ja tämän metallin fysikaalisten ominaisuuksien metallinen linkki voidaan selittää teoriassa. Kumpikaan ei kuitenkaan selitä miksi Chromessa voi olla useita valtioita tai hapettumislukuja.
Tätä varten syvä ymmärrys atomin vakaudesta elektronisten pyörien suhteen.
Kromin hapettumisnumero
Koska Chromen elektroninen kokoonpano on [AR] 4S13D5 Voit voittaa jopa yhden tai kaksi elektronia (CR1- ja cr2-) tai menettää heidät hankkimaan erilaisia hapettumislukuja.
Siten, jos kromi menettää elektronin, se olisi yhtä [ar] 4s0 -3D5; Jos menetät kolme, [ar] 4s0 -3D3; Ja jos menetät ne kaikki, [ar] tai mikä on sama, se olisi eristävää argonia.
Voi palvella sinua: kiehumiskohta: Konsepti, laskenta ja esimerkitKromi ei menetä tai saa elektroneja pelkän mielipiteen vuoksi: On oltava laji, joka tehdään tai hyväksyä ne siirtyäksesi hapetusnumerosta toiseen.
Kromissa on seuraavat hapettumisnumerot: -2, -1, 0, +1, +2, +3, +4, +5 ja +6. Heistä +3, cr3+, Se on vakain ja siksi hallitseva kaikista; jota seuraa +6, cr6+.
Chrome käyttää
Väriaineena tai pigmentinä
Kromilla on laaja valikoima sovelluksia, väriaineista erityyppisille kankaille, suojaa, joka kaunistaa metallikappaleita, niin kutsuttu kromattu, joka voidaan tehdä puhtaalla metallilla tai CR -yhdisteillä (III) tai CR (Vi).
Cromic Fluoruro (CRF3), esimerkiksi sitä käytetään väriaineena villakankaissa; Cromic -sulfaatti (CR2(SW4-A3), sen on tarkoitus värjätä emalit, keramiikka, maalaukset, musteet, lakat ja palvelee myös kromimetalleja; ja kromioksidi (CR2JOMPIKUMPI3) Etsi myös käyttöä, missä sen houkutteleva vihreä väri vaaditaan.
Siksi minkä tahansa voimakkaan värin kromin mineraalilla voidaan tarkoitus värjätä rakenne, mutta sen jälkeen tosiasia siitä, ovatko nämä yhdisteet vaarallisia vai ei ympäristölle vai yksilöiden terveydelle.
Itse asiassa sen myrkyllisiä ominaisuuksia käytetään puu- ja muiden hyönteisten hyökkäyspintojen säästämiseen.
Kromoidussa tai metallurgiassa
Samoin lisätään pieniä määriä kromia terästä, jotta sitä voidaan vahvistaa hapettumisen ja sen kirkkauden parantamiseksi. Tämä johtuu siitä, että se pystyy muodostamaan harmaat karbidit (CR3C2) Erittäin kestävä reagoidessaan ilman hapen kanssa.
Voi palvella sinua: kalsiumhydroksidi (CA (OH) 2): rakenne, ominaisuudet, hankkiminen, käyttöKoska kromi voi kiillottaa kirkkaisiin pintoihin, kromi esittelee sitten hopeamallit ja värit halvempana vaihtoehtona näihin tarkoituksiin.
Ravitsemus-
Jotkut keskustelut, jos kromia voidaan pitää välttämättömänä elementtinä, ts. Välitöntä päivittäisessä ruokavaliossa. Sitä esiintyy joissain elintarvikkeissa hyvin pienissä pitoisuuksissa, kuten vihreät lehdet ja tomaatit.
On myös proteiinilisäaineita, jotka säätelevät insuliiniaktiivisuutta ja suosittelevat lihasten kasvua, kuten Chrome Polynicotinatossa.
Missä on kromi?
Kromia löytyy monenlaisista mineraaleista ja jalokivistä, kuten rubiineista ja smaragdeista. Tärkein mineraali, josta kromi uutetaan, on kromiitti (MCR2JOMPIKUMPI4), Missä m voi olla mikä tahansa muu metalli, johon kromioksidi liittyy. Näitä kaivoksia on runsaasti Etelä -Afrikassa, Intiassa, Turkissa, Suomessa, Brasiliassa ja muissa maissa.
Jokaisessa lähteessä on yksi tai useampi kromi -variantti. Tällä tavalla jokaiselle M: lle (usko, MG, MN, Zn jne.) Erilainen kromi mineraali syntyy.
Metallin purkamiseksi se on välttämätöntä. Tämä tehdään hiilellä tai alumiinilla:
Fikko2JOMPIKUMPI4 + 4C => Fe + 2Cr + 4Co
Samoin kromita löytyy (PBCRO4-A.
Yleensä missä tahansa mineraalissa, jossa ioni cr3+ voi korvata Al3+, Molemmat ovat hiukan samanlaisia ioniradioita, on epäpuhtaus, joka johtaa tähän hämmästyttävän mutta haitallisen metallin luonnolliseen lähteeseen.
Viitteet
- Tenebaum e. Kromi. Otettu: kemia.Pomona.Edu
- Kemian librettexts. Kromin kemia. Otettu: Chem.Librettexts.org
- Kromi. Otettu: Chemistry Explated.com

