Halogenoidut johdannaiset

- 4290
- 12
- Sheldon Kuhn
Selitämme, mitkä halogenoidut johdannaiset, niiden ominaisuudet, käyttö/sovellukset ovat ja annamme useita esimerkkejä
Mitkä ovat halogenoidut johdannaiset?
Se halogenoidut johdannaiset Ne ovat kaikki yhdisteitä, joissa on halogeeniatomi; eli mikä tahansa ryhmän 17 elementeistä (F, Cl, BR, I). Nämä elementit eroavat muusta, koska ne ovat elektronegatiivisempia, muodostaen epäorgaanisen ja orgaanisen halogenian monimuotoisuuden.
Halogeenien alempi kuva on esitetty alemmassa kuvassa. Ylhäältä alas: fluori (F2), Kloori (Cl2), Bromo (BR2) ja jodi (i2-A. Jokaisella näistä on kyky reagoida valtaosan elementtien kanssa, mukaan lukien saman ryhmän keskuudessa (interhalogeenit) välillä.

Siten halogenoiduilla johdannaisilla on MX -kaava, jos se on metalli haluro, rx, jos se on alkyyli ja arx. Kaksi viimeistä sijaitsevat Organic Haluros -luokassa. Näiden yhdisteiden stabiilisuus vaatii energian "hyötyä" alkuperäisen soodamolekyylin edessä.
Yleensä fluori muodostaa halogeenisoitua stabiilia kuin jodi. Syynä johtuu niiden atomiradioiden välisistä eroista (violetti pallot ovat enemmän tilaa vieviä kuin keltaiset).
Lisäämällä atomisädettä halogeenin ja toisen atomin välisten kiertoratojen päällekkäisyys on heikompi, ja siksi linkki on heikompi.
Nimikkeistö
Tapa näiden yhdisteiden oikein nimeämiseen riippuu siitä, ovatko ne epäorgaanisia vai orgaanisia.
Epäorgaaninen
Metalliset halogenidit koostuvat sidoksesta, ionisesta tai kovalentista, halogeenin X ja M -metallin välillä (ryhmät 1 ja 2, siirtymämetallit, raskasmetallit jne.-A.
Näissä yhdisteissä kaikkien halogeenien hapetustila on -1. Koska? Koska sen Valencia -kokoonpanot ovat NS2NP5.
Siksi heidän on voitettava vain yksi elektroni Valencian oktetin loppuun saattamiseksi, kun taas metallit hapettuu, antaen heille heidän elektronit.
Voi palvella sinua: Precision Balance: Ominaisuudet, toiminnot, osat, käyttötarkoituksetSiten fluori pysyy F: ksi-, fluori; Cl-, kloridi; br-, bromidi; Ja minä-, Viimeisenä. MF nimetään: (metallinimi) (n) fluori, joka on Valencia del -metalli vain, kun siinä on enemmän kuin yksi. Ryhmien 1 ja 2 ryhmien tapauksessa Valencia ei ole välttämätöntä nimetä.
Esimerkit
- NAF: Natriumfluori.
- Kacl2: kalsiumkloridi.
- AGBR: Hopeabromidi.
- Zni2: Sinkki Yoduro.
- CUCL: Kuparikloridi (I).
- Cucl2: kuparikloridi (II).
- Tikli4: Titaniumkloridi (IV) tai Titano -tetrakloridi.
Vety- ja ei -metallielementit - jopa samat halogeenit - voivat kuitenkin myös muodostaa haluroja. Näissä tapauksissa NO -metallin valenciaa ei nimitetä lopussa:
- PCL5: fosfori -pentakloridi.
- Bf3: Boro Trifluoruro.
- Ali3: Alumiini triyoduro.
- HBR: vetybromidi.
- Jos7: jodi heptofluoridi.
Luomu
Riippumatta siitä, onko RX vai ARX, halogeeni on kovalenttisesti kytketty hiiliatomiin. Näissä tapauksissa halogeenit mainitaan niiden nimien mukaan, ja loput nimikkeistöstä riippuu R: n tai AR: n molekyylirakenteesta.
Yksinkertaisimmalle orgaaniselle molekyylille, metaanille (CHO4), Seuraavat johdannaiset saadaan korvaamalla H CL: llä:
- CH3CL: klorometaani.
- CH2Cl2: dikloorimetaani.
- CHCL3: trisyylorometaani (kloroformi).
- CCL4: Tetrakloorimetaani (hiilikloridi (IV) tai hiilitetrakloridi).
Täällä r koostuu yhdestä hiiliatomista. Sitten muille alifaattisille ketjuille (lineaariset tai oksat) hiilihiilien lukumäärä lasketaan, josta se on kytketty halogeeniin:
CH3CH2CH2F: 1-Fluorpropano.
Edellinen esimerkki oli ensisijainen alquilical Halogen. Jos ketju on haarautunut, pisin halogeeni on valittu ja alkaa laskea, jättäen tämän mahdollisella tavalla:
Voi palvella sinua: mitkä ovat aineen fysikaaliset ominaisuudet?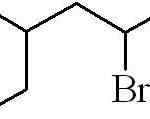
3-metyyli-5-bromohexan
Samoin se tapahtuu muille substituenteille. Aromaattisissa halogenideissa halogeeni nimitetään myös sitten loput rakenteesta:

Ylivoimainen kuva näyttää bromobentseenin nimisen yhdisteen, joka korostaa bromiatomia ruskeissa.
Halogenoitujen johdannaisten ominaisuudet
Epäorgaaniset halogenidit
Epäorgaaniset halogenidit ovat ionisia tai molekyylisiä kiinteitä aineita, vaikka entiset ovat runsaampia. MX: n vuorovaikutuksista ja ionisista radioista riippuen tämä liukenee veteen tai muihin vähemmän polaarisiin liuottimiin.
Ei -metalliset halogenidit (kuten boro) ovat yleensä Lewis -happoja, mikä tarkoittaa, että ne hyväksyvät elektroneja muodostaen komplekseja. Toisaalta vedessä liuenneen vedyn halogenidit (tai halogeeniseturot) tuottavat nimeä, joita kutsutaan hydrakeiksi.
Sen sulamispisteet, kiehuminen tai sublimointi putoavat sähköstaattisiin tai kovalenttisiin vuorovaikutuksiin metallin tai ei -metallin välillä halogeenin kanssa.
Samoin ionisillä radioilla on tärkeä rooli näissä ominaisuuksissa. Esimerkiksi, jos m+ ja x- Heillä on samanlaisia kokoja, heidän kiteet ovat vakaampia.
Orgaaniset halogenidit
Ne ovat polaarisia. Koska? Koska C: n ja halogeenin välisen elektronegatiteetin ero luo pysyvän polaarisen momentin molekyylissä. Lisäksi tämä vähenee, kun ryhmä 17 laskeutuu C-F-linkistä C-I: hen.
Ottamatta R: n tai AR: n molekyylirakennetta, kasvavat halogeenimäärät vaikuttavat suoraan kiehumispisteisiin, koska ne lisäävät molekyylien välisiä vuorovaikutuksia (RC-X-X-CR). Useimmat ovat sekoittumattomia vedellä, mutta ne voivat liukene orgaanisiin liuottimiin.
Halogenoitujen johdannaisten käyttö
Halogenoitujen johdannaisten käyttö voisi varata oman tekstinsä. Halogeenien molekyyli "seuralaiset" ovat avaintekijä, kun otetaan huomioon, että niiden ominaisuudet ja reaktiivisuudet määrittelevät johdannaisen käytön.
Voi palvella sinua: kaliumsulfaatti (K2SO4): rakenne, ominaisuudet, käytöt, synteesiSiten mahdollisten käyttötarkoituksen monimuotoisuuden joukossa seuraava erottuva:
- Molekyylihalogeeneja käytetään halogeenipulppujen luomiseen, missä saat yhteyden hehkulamppuun volframilehkäreeseen. Tämän seoksen tarkoituksena on reagoida halogeeni X haihtuneen volframin kanssa. Tällä tavoin sen laskeuma vältetään lampun pinnalla, mikä takaa enemmän käyttöikää.
- Fluorisuoloja käytetään hammasveden ja pastien fluoraamisessa.
- Natrium- ja kalsiumhypokloriitit ovat kaksi aktiivista ainetta kaupallisissa valkaisuliuoksissa (kloori).
- Vaikka ne huononevat otsonikerroksen, aerosoleissa ja jäähdytysjärjestelmissä käytetään kloorofluorihiilivetyjä (CFC).
- Vinyylikloridi (CHO2= CHCL) on polyvinyylipolymeerikloridin (PVC) monomeeri (PVC). Toisaalta teflonia, jota käytetään ei -tikakalvona, koostuu tetrafluorietyleenin polymeeriketjuista (F2C = vrt2-A.
- Niitä käytetään analyyttisessä kemiassa ja orgaanisessa synteesissä eri tarkoituksiin; Näistä lääkkeen synteesi.
Lisäesimerkkejä

Ylivoimainen kuva kuvaa kilpirauhashormonia, joka on vastuussa lämmöntuotannosta ja kehon yleisen aineenvaihdunnan lisääntyminen. Tämä yhdiste on esimerkki ihmiskehossa läsnä olevasta halogenoidusta johdannaisesta.
Seuraava mainitaan muun muassa halogenoitujen yhdisteiden joukossa:
- Dikloorodifenilriikloorotaani (DDT), tehokas hyönteismyrkky, mutta vakavilla ympäristövaikutuksilla.
- Tinakloridi (snncl2), käytetään pelkistävänä aineena.
- Kloorietaani tai 1-kloorietaani (CH3CH2Cl), ajankohtainen anestesia, joka toimii nopeasti ihon jäähdytyksessä.
- Dikloorietyleeni (CLCH = CCLH) ja tetrakloorietyleeni (CL2C = ccl2), käytetään liuottimina kuivapesualalla.
- « Piharbidikemiallinen rakenne, ominaisuudet ja käytöt
- 80 lauseita ensimmäiselle rakkaudelle, joka ei koskaan unohda »

