Proteiinin denaturointi Mikä on, tekijät, seuraukset
- 1225
- 342
- Shawn Stanton II
Mikä on proteiinien denaturointi?
Se proteiinin denaturointi Se koostuu kolmen ulottuvuuden rakenteen menetyksestä erilaisista ympäristötekijöistä, kuten lämpötilasta, pH: sta tai tietyistä kemiallisista aineista. Rakenteen menetys johtaa siihen proteiiniin liittyvän biologisen toiminnan menetykseen, onko entsymaattinen, rakenteellinen, kuljettaja, muun muassa.
Proteiinin rakenne on erittäin herkkä muutoksille. Yhden välttämättömän vetysillan epävakauttaminen voi denaturalisoida proteiinin. Samoin on vuorovaikutuksia, jotka eivät ole ehdottomasti välttämättömiä proteiinifunktion toteuttamiseksi, ja epävakauden tapauksessa sillä ei ole vaikutusta toimintaan.
Proteiinirakenne
Proteiinien denaturointiprosessien ymmärtämiseksi meidän on tiedettävä kuinka proteiinit järjestetään. Näillä on ensisijainen, toissijainen, tertiäärinen ja kvaternäärinen rakenne.
Ensisijainen rakenne
Aminohapposekvenssi muodostavat tämän proteiinin. Aminohapot ovat perustavanlaatuisia lohkoja, jotka muodostavat nämä biomolekyylit, ja niitä on 20 erityyppistä, jokaisella on erityiset fysikaaliset ja kemialliset ominaisuudet. Ne liittyvät yhdessä peptidilinkin avulla.
Toissijainen rakenne
Tässä rakenteessa tämä aminohappojen lineaarinen ketju alkaa taittaa vety silloilla. Toissijaisia perusrakenteita on kaksi: a -potkuri, spiraalimuotoinen; ja taitettava lehti β, kun kaksi lineaarista ketjua on kohdistettu rinnakkain.
Korkea -asteen rakenne
Siihen sisältyy muun tyyppisiä voimia, jotka johtavat kolmen dimensioisen muodon erityiseen taittamiseen.
Aminohappotähteiden R -ketjut, jotka muodostavat proteiinin rakenteen. Van der Waalsin joukot toimivat kuvatun vuorovaikutusten stabilointinä.
Voi palvella sinua: isoleusiini: ominaisuudet, toiminnot, biosynteesi, ruokaKvaternäärinen rakenne
Se koostuu proteiiniyksiköiden aggregaateista.
Kun proteiini denaturoitu, se menettää kvaternäärisen, tertiäärisen ja sekundaarisen rakenteen, kun taas primaari pysyy ennallaan. Proteiinit, joissa on runsaasti disulfidilinkkejä (tertiäärinen rakenne), antavat suuremman denaturoiniresistenssin.
Tekijät, jotka aiheuttavat denaturointia
Kaikki tekijät, jotka destabilisoivat ei -kovalenttisia sidoksia, jotka vastaavat proteiinin natiivirakenteen ylläpidosta, voivat tuottaa denaturoitumisensa. Tärkeimpien joukossa voimme mainita:
PHE
Hyvin äärimmäisissä pH -arvoissa, happamat tai emäksiset keskiarvot, proteiini voi menettää kolmiulotteisen kokoonpanonsa. Ylimääräinen hones h+ ja oh- keskellä destabilisoi proteiinien vuorovaikutuksia.
Tämä ionikuvion muutos tuottaa denaturoinnin. PH -denaturointi voi olla palautuvaa joissain tapauksissa ja muissa peruuttamattomissa.
Lämpötila
Lämpö denaturointi tapahtuu nostamalla lämpötilaa. Keskimääräisissä ympäristöolosuhteissa elävissä organismeissa proteiinit alkavat destabilisoida yli 40 ° C: n lämpötiloissa. On selvää, että termofiiliset organismiproteiinit voivat tukea näitä lämpötila -alueita.
Lämpötilan nousut siirretään molekyyliliumien ja muiden ei -kovalenttisten sidosten lisääntymiseen, mikä johtaa tertiäärisen rakenteen menetykseen.
Nämä lämpötilan nousut johtavat reaktionopeuteen, jos puhumme entsyymeistä.
Kemialliset aineet
Polaariset aineet - kuten urea - korkeissa pitoisuuksissa vaikuttavat vety siltoihin. Samoin ei -polaarisilla aineilla voi olla samanlaisia seurauksia.
Pesuaineet voivat myös destabiloida proteiinirakenteen; Se ei kuitenkaan ole aggressiivinen prosessi ja ne ovat enimmäkseen palautuvia.
Voi palvella sinua: Saksan torakka: Ominaisuudet, lisääntyminen, ruokaVähentävät edustajat
Β-merkaptoetanoli (HOCH2CH2SH) on usein käytetty kemiallista ainetta laboratoriossa proteiinien denaturointiin. Se vastaa disulfidisiltojen vähentämisestä aminohappojätteen välillä. Voi destabiloida proteiinin tertiäärisen tai kvaternäärisen rakenteen.
Toinen pelkistävä aine, jolla on samanlaiset toiminnot. Lisäksi muut proteiinien natiivien rakenteen menetyksen aiheuttavat tekijät ovat raskasmetalleja korkeissa pitoisuuksissa ja ultraviolettisäteily.
Seuraukset proteiinin denaturointi
Kun denaturalisaatio tapahtuu, proteiini menettää toimintansa. Proteiinit toimivat optimaalisesti, kun he ovat alkuperäisessä tilassaan.
Funktion menetys ei aina liity denaturointiprosessiin. Pieni muutos proteiinirakenteessa voi johtaa toiminnan menetykseen ilman,.
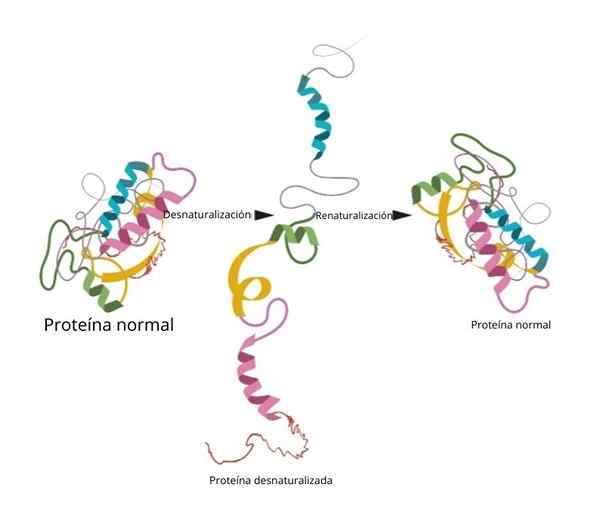
Prosessi voi olla peruuttamaton tai ei. Laboratoriossa, jos olosuhteet käännetään, proteiini palaa alkuperäiseen kokoonpanoonsa.
Renaturalisaatio
Yksi tunnetuimmista ja vakuuttavimmista kokeista renaturalisaatiosta osoitettiin ribonukleaasissa.
Kun tutkijat lisäsivät denaturoivia aineita, kuten urea tai β-merkaptanoli, proteiini denaturoitiin. Jos nämä aineet poistettaisiin, proteiini palasi alkuperäiseen konformaatioonsa ja voisi suorittaa toimintansa 100 -prosenttisella tehokkuudella.
Yksi tämän tutkimuksen tärkeimmistä johtopäätöksistä oli kokeellisesti osoittaa, että proteiinin kolme dimensionaalista konformaatiota annetaan sen ensisijaisella rakenteella.
Joissakin tapauksissa denaturalisointiprosessi on täysin peruuttamaton. Esimerkiksi, kun keittämme muna. Intuitiivisesti voi päätellä, että vaikka jäähdytämme sitä, se ei palaa alkuperäiseen muotoonsa.
Voi palvella sinua: Ovogeneesi: vaiheet, eläinten ja kasvien ominaisuudetUseimmissa tapauksissa denaturalisointiprosessiin liittyy liukoisuuden menetys. Viskositeetti, diffuusionopeus myös vähenee ja kiteytyy helpommin.
Chaperonas -proteiinit
Chaperonas- tai chaperoniiniproteiinit ovat vastuussa muiden proteiinien denaturoinnin estämisestä. He myös tukahduttavat tiettyjä vuorovaikutuksia, jotka eivät ole riittäviä proteiinien keskuudessa niiden oikean taittumisen varmistamiseksi.
Kun keskilämpötila nousee, nämä proteiinit lisäävät niiden pitoisuutta ja vaikuttavat estämällä muiden proteiinien denaturoinnin. Siksi heitä kutsutaan myös "lämpökokkiproteiineiksi" tai HSP: n lyhenteelle englanniksi (Lämpö sokkiproteiinit-A.
Chaperoniinit ovat analogisia häkin tai tynnyrin kanssa, joka suojaa kiinnostavaa proteiinia sisällä.
Näitä solun stressitilanteisiin reagoivia proteiineja on raportoitu erilaisissa elävien organismien ryhmissä ja ovat erittäin säilyneitä. Chaperoniineja on erilaisia ja luokitellaan niiden molekyylipainon mukaan.

