Rikkidioksidi (SO2) rakenne, ominaisuudet, käytöt, riskit

- 3629
- 729
- Edgar VonRueden
Hän rikkidioksidi Se on kaasumainen epäorgaaninen yhdiste, joka on muodostanut rikki (S) ja happi (O), se on sen kemiallinen kaava niin2. Se on väritön kaasu, jolla on ärsyttävä ja tukahduttava haju. Lisäksi se on vesiliukoista muodostavia happoliuoksia. Tulivuoret karkottaa hänet ilmakehään purkausten aikana.
Se on osa rikin biologista ja geokemiallista sykliä, mutta sitä tuotetaan suurina määrinä tietyillä ihmisen toiminnalla, kuten öljyn jalostaminen ja fossiilisten polttoaineiden polttaminen (esimerkiksi hiili tai diesel).
 Rikkidioksidi niin2 Volcanoes julkaisee purkausten aikana. Brocken Inaglory [CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Rikkidioksidi niin2 Volcanoes julkaisee purkausten aikana. Brocken Inaglory [CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Niin2 Se on pelkistävä aine, joka antaa paperimassan pysyä valkoisena rahanpesun jälkeen muiden yhdisteiden kanssa. Sen tarkoituksena on myös eliminoida kloorin jäänteet veteen, joka on käsitelty tällä kemistillä.
Sitä käytetään jonkin tyyppisten ruokien pitämiseen, astioiden desinfiointiin, joissa rypälemehun käyminen tapahtuu viinin tai ohran tuottamiseksi oluen valmistamiseksi.
Sitä käytetään myös maatalouden sienitautien torjunta -aineena rikkihapon saamiseksi liuottimena ja välittäjänä kemiallisissa reaktioissa.
Niin2 Ilmakehässä läsnä on monille kasveille haitallinen, vedessä kalat vaikuttavat ja on myös yksi niistä, jotka vastaavat "hapan sateesta", joka syöttää ihmisen luomia materiaaleja.
[TOC]
Rakenne
Rikkidioksidimolekyyli on symmetrinen ja muodostaa kulman. Kulma johtuu siitä, että niin2 Siinä on pari yksinäistä elektronia, ts. Elektronit, jotka muodostavat yhteyden mihin tahansa atomiin, mutta ovat ilmaisia.
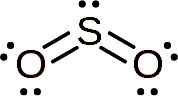 Rikkidioksidin Lewis -rakenne, jossa havaitaan sen kulmanmuoto ja vapaiden elektronien pari. Whittlemario [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
Rikkidioksidin Lewis -rakenne, jossa havaitaan sen kulmanmuoto ja vapaiden elektronien pari. Whittlemario [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. Nimikkeistö
- Rikkidioksidi
- Rikihydridi
- Rikkioksidi.
Ominaisuudet
Fyysinen tila
Väritön kaasu.
Molekyylipaino
64,07 g/mol
Sulamispiste
-75,5 ºC
Kiehumispiste
-10,05 ºC
Tiheys
Kaasu: 2,26 - 0 ° C (suhteessa ilmaan, ts. Ilman tiheys = 1). Tämä tarkoittaa, että se on raskaampi kuin ilma.
Neste: 1,4 a -10 ° C (suhteessa veteen, ts. Vesitiheys = 1).
Liukoisuus
Vesiliukoinen: 17,7% 0 ° C: ssa; 11,9% 15 ° C: ssa; 8,5% 25 ° C: ssa; 6,4% 35 ° C: ssa.
Liukoinen etanoliin, dietyl -eetteriin, asetoniin ja kloroformiin. Se on vähemmän liukoinen ei -polaarisiin liuottimiin.
PHE
Vesipitoiset SOS -ratkaisut2 Ne ovat happamia.
Kemialliset ominaisuudet
Niin2 Se on voimakas pelkistävä ja hapettava aine. Ilman läsnä ollessa ja katalyytti hapettaa niin3.
Sw2 + JOMPIKUMPI2 → Joten3
Yksinäisten elektronien parit tekevät siitä joskus käyttäytymisen Lewisin pohjana, toisin sanoen se voi reagoida yhdisteiden kanssa, joissa on atomi, josta puuttuu elektroneja.
Se voi palvella sinua: Raudan arkistointi: Ominaisuudet, miten ne valmistetaan, myrkyllisyys, käyttöJos niin2 Se on kaasun ja kuiva muodossa ei hyökkää rautaa, terästä, kuparin-nikkeliseoksista tai nikkeli-kromi-hydrroa. Kuitenkin, jos se on nestemäisessä tai kosteassa tilassa, se tuottaa korroosiota näihin metalleihin.
Niin2 Neste, jolla on 0,2% vettä tai enemmän, tuottaa voimakasta rautaa, messinkiä ja kuparikorroosiota. Se on syövyttävää alumiinille.
Kun se on neste.
Vesipitoinen SOS niin2
Niin2 Se on hyvin liukoinen veteen. Pitkän ajan pidettiin pitkään, että vesirikkihappo muodostuu h2Sw3, Mutta tämän hapon olemassaoloa ei ole osoitettu.
Niin ratkaisuissa2 Vedessä seuraavat saldot:
Sw2 + H2Tai ⇔ niin2.H2JOMPIKUMPI
Sw2.H2Tai ⇔ HSO3- + H3JOMPIKUMPI+
HSO3- + H2Tai ⇔ niin32- + H3JOMPIKUMPI+
Missä HSO3- Se on bisulfiitti -ioni ja SO32- Se on sulfiitti -ioni. Sulfit -ioni niin32- Se tapahtuu pääasiassa, kun alkali lisätään SO -liuokseen2.
Vesipitoiset SOS -ratkaisut2 Heillä on vähentyviä ominaisuuksia, varsinkin jos ne ovat alkali.
Muut ominaisuudet
- Se on erittäin stabiili verrattuna lämpötilaan, jopa 2000 ° C: seen.
- Se ei ole syttyvä.
Saada
Niin2 Se saadaan ilmassa rikin palamisella (t), vaikkakin muodostetaan myös pieniä määriä niin muotoa3.
S + o2 → Joten2
Sitä voidaan tuottaa myös lämmittämällä muun muassa erilaisten sulfidien, polttamalla pyrite -mineraalien ja mineraalien, jotka sisältävät sulfideja.
Rautapyriitin tapauksessa hapettua rautaoksidia (III) ja samoin saadaan2-
4 fes2 + 11 o2 → 2 uskoa2JOMPIKUMPI3 + 8 niin2↑
Läsnäolo luonnossa
Niin2 Se vapautuu ilmakehään tulivuoren aktiivisuudella (9%), mutta se on myös peräisin muista luonnollisista toiminnoista (15%) ja ihmisen toiminnasta (76%).
Räjähtävät vulkaaniset purkaukset aiheuttavat merkittäviä vuotuisia vaihtelut tai variaatiot2 ilmakehässä. Arvioidaan, että 25% SO: sta2 Volcanoes -lähettämät säteilee sadetta ennen stratosfäärin saavuttamista.
Luonnolliset lähteet ovat runsaimpia ja johtuvat rikin biologisesta syklistä.
Kaupunkialueilla ja teollisuusalueilla ihmislähteet ovat vallitsevia. Tärkein ihmisen toiminta, joka tuottaa, on fossiilisten polttoaineiden, kuten hiilen, bensiinin ja dieselin, polttaminen. Muita ihmislähteitä ovat öljynjalostamot, kemialliset kasvit ja kaasun tuotanto.
 Ihmisen toiminta, kuten sähkön polttaminen, ovat niin pilaantumisen lähde2. Adrem68 [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
Ihmisen toiminta, kuten sähkön polttaminen, ovat niin pilaantumisen lähde2. Adrem68 [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. Nisäkkäissä se syntyy endogeenisellä tavalla, toisin sanoen eläinten ja ihmisten kehossa rikkiä sisältävien aminohappojen aineenvaihdunnan vuoksi, erityisesti L-systeiiniä.
Voi palvella sinua: Nestemäiset elementit: Mitkä ovat ja esimerkkejäSovellukset
Rikkihapon tuotannossa
Yksi SO: n tärkeimmistä sovelluksista2 Se on rikkihappoa H hankkia2Sw4.
2 niin2 + 2 h2Tai + o2 → 2 h2Sw4
Jalostetussa elintarviketeollisuudessa
Rikkidioksidia käytetään elintarvikkeiden säilöntäaineena ja stabilointiaineena kosteudenhallinnan aineena ja tiettyjen syötävien tuotteiden maun ja tekstuurin modifikaattorina.
Sitä käytetään myös laitteiden desinfiointiin, jotka joutuvat kosketuksiin päivittäistavaroiden, käymislaitteiden, kuten panimoiden ja elintärkeiden, ruokaratkaisujen jne.
Se mahdollistaa hedelmien ja vihannesten säilyttämisen, pidentää sen käyttöikää supermarketin hyllyllä, estää värin ja maun menettämisen ja auttaa C -vitamiinin (askorbiinihappo) ja karoteenin (A -vitamiinin edeltäjien) pidättämisessä (ASkorbiinihappo).
 Kuivattuja hedelmiä on edelleen vapaa sienistä ja bakteereista SO: n ansiosta2. Kirjoittaja: Isabel Ródenas. Lähde: Pixabay.com
Kuivattuja hedelmiä on edelleen vapaa sienistä ja bakteereista SO: n ansiosta2. Kirjoittaja: Isabel Ródenas. Lähde: Pixabay.com Se palvelee viiniä, koska se tuhoaa bakteerit, sienet ja ei -toivotut hiivat. Sitä käytetään myös nitrosamiinien muodostumisen sterilointiin ja estämiseen oluessa.
 Ohran käymislaitteet oluen steriloinnin saamiseksi niin2. Kirjoittaja: ceridebbie. Lähde: Pixabay.
Ohran käymislaitteet oluen steriloinnin saamiseksi niin2. Kirjoittaja: ceridebbie. Lähde: Pixabay. Sitä käytetään myös maissijyvien liottamiseen, juurikkaiden sokerin valkaisuun ja antimikrobisena korkean fruktoosin maissisiirappin valmistuksessa.
Liuottimena ja reaktiivisena
Sitä on käytetty laajasti ei -laatuisena liuottimena. Vaikka se ei ole ionisoiva liuotin, se on hyödyllinen liuottimena, joka ei ole protoneja tiettyihin analyyttisiin sovelluksiin ja kemiallisiin reaktioihin.
Sitä käytetään liuottimena ja reagenssina orgaanisessa, välittäjänä muiden yhdisteiden, kuten klooridioksidin, asetyylikloridin ja öljysulfonaation tuotannossa.
Pelkistävänä aineena
Sitä käytetään pelkistävänä aineena huolimatta siitä, että se ei ole niin vahva, ja alkalisessa liuoksessa muodostuu sulfiitti -ioni, joka on energisempi pelkistävä aine.
Useissa sovelluksissa
Niin2 Sitä käytetään myös:
- Maataloudessa, kuten sienitautien ja rypäleen säilöntäaine sadonkorjuun jälkeen.
- Hydrosulfiitin valmistus.
- Valkaisuainetta ja paperimassan, koska se mahdollistaa massan stabiloinnin pesun jälkeen vetyperoksidilla H2JOMPIKUMPI2; Niin2 toimii tuhoamalla H2JOMPIKUMPI2 jäännös ja pidä siten massan kirkkaus, kuten h2JOMPIKUMPI2 voi aiheuttaa kirkkauden kääntymisen.
- Valkaisuainetta tekstiilikuituja ja pajuartikkeleita.
- Vesien hoitoon se eliminoi jäännöskloorin, joka jää juomaveden, jäteveden tai teollisuusvesien kloorauksen jälkeen.
- Mineraalien ja metallien puhdistamisessa raudan pelkistävänä aineena mineraalien prosessoinnin aikana.
- Öljyn puhdistamisessa happea ja viivästyttää korroosiota ja uuttoliuotinta.
Voi palvella sinua: kemiallisten yhtälöiden tasapainottaminen- Antioksidanttina.
- Alkalin neutralisaattorina lasinvalmistuksessa.
- Litiumparistoissa hapettavana aineena.
Niin vaikutukset2 endogeeninen
Tietyt tutkimukset ovat paljastaneet sen2 Itse organismin endogeenisella tai tuottamalla tuottamalla on hyödyllinen vaikutus sydän- ja verisuonijärjestelmään, mukaan lukien sydämen toiminnan säätely ja verisuonten rentoutuminen.
Kun niin tapahtuu organismissa2 Siitä tulee sen johdannaisia bisulfiitti HSO3- ja sulfiitti niin32-, jotka vaikuttavat Vasorelajadorin vaikutukseen valtimoihin.
Niin2 Endogeeninen vähentää verenpainetapaa, estää ateroskleroosin kehittymistä ja suojaa sydänlihavaurioita. Sillä on myös antioksidanttivaikutus, estää tulehdusta ja apoptoosia (ohjelmoitu solukuolema).
Näistä syistä ajatellaan, että se voi olla mahdollista uusi terapia sydän- ja verisuonisairauksille.
 Sydän voi hyötyä niin2 Organismin tuottama. Kirjoittaja: OpenClipart-Vektorit. Lähde: Pixabay.
Sydän voi hyötyä niin2 Organismin tuottama. Kirjoittaja: OpenClipart-Vektorit. Lähde: Pixabay. Riskejä
- Altistuminen niin2 Kaasuma voi johtaa silmien, ihon, kurkun ja limakalvojen palovammoihin, keuhkojen ja keuhkojen vaurioihin.
- Jotkut tutkimukset kertovat, että sillä on potentiaalinen vaurioiden riski nisäkkäiden ja ihmisen solujen geneettiselle materiaalille.
- Se on syövyttävää. Se ei ole syttyvä.
Ekotoksisuus
Rikkidioksidi on yleisin pilaavan aineen kaasu ilmakehässä, etenkin kaupunki- ja teollisuusalueilla.
Sen läsnäolo ilmakehässä myötävaikuttaa niin kutsuttuun "hapan sateeseen", joka on haitallista vesieliöille, kaloille, maan kasvillisuudelle ja korroosiolle ihmisen tekemistä materiaaleihin.
 Hapon sateen vaurioitunut muistomerkki. Nino Barbieri [CC BY-S (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]. Lähde: Wikimedia Commons.
Hapon sateen vaurioitunut muistomerkki. Nino Barbieri [CC BY-S (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]. Lähde: Wikimedia Commons. Niin2 Se on myrkyllistä kalolle. Vihreät kasvit ovat erittäin herkkiä niin2 ilmakehän. Sinimailma-, puuvilla-, ohra ja vehnä vaurioituvat alhaisella ympäristötasolla, kun taas perunat, sipulit ja maissit ovat paljon kestävämpiä.
Sen nielemisen vaikutukset ruoan kanssa
Vaikka SO on vaarattomia terveille ihmisille, kun niitä käytetään valtuutettujen terveysvirastojen suosittelemiin pitoisuuksiin, niin2 voi saada astman herkille ihmisille, jotka nauttivat sen ruoalla.
 Herkät ihmiset voivat kärsiä astmasta nauttien ruokaa pienillä määrillä niin2. Suraj Malayalam Wikipediassa [julkinen alue]. Lähde: Wikimedia Commons.
Herkät ihmiset voivat kärsiä astmasta nauttien ruokaa pienillä määrillä niin2. Suraj Malayalam Wikipediassa [julkinen alue]. Lähde: Wikimedia Commons. Ruoat, jotka yleensä sisältävät sitä, ovat kuivattuja hedelmiä, keinotekoisia virvoitusjuomia ja alkoholijuomia.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Dioksidirikki. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Huang, ja. et al. (2016). Endogeeninen rikkidioksidi: Uusi gasotransmitter -perheen täyteläinen sydän- ja verisuonijärjestelmässä. Oksidi -med -solu Longev. 2016; 2016: 8961951. NCBI toipunut.Nlm.NIH.Hallitus.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Windholz, m. et al. (Toimittajat) (1983). Merck -indeksi. Kemikaalien, lääkkeiden ja biologisten enyclopedia. Kymmenes painos. Merck & Co., Inc.
- Leipä, x. (2011). Oksidien rikki: Lähteet, valotukset ja terveysvaikutukset. Rikkioksidien terveysvaikutukset. Ympäristöterveyden tietosanakirjassa. ScienEdirect.com.
- Huijaaja, R. ja huijaaja, s. (1999). Epäpuhtaudet ja epäpuhtaudet. Rikkidioksidi. Sähkömekaanisten ja elektronisten laitteiden ympäristövaatimuksissa. ScienEdirect.com.
- Bleam, W. (2017). Happo-emäskemia. Oksidi -rikki. Maaperässä ja ympäristökemiassa (toinen painos). ScienEdirect.com.
- Freedman, b.J -. (1980). Rikkidioksidi elintarvikkeissa ja juomissa: sen käyttö säilöntäaineena ja sen vaikutus astmaan. Br j dis rintakehä. 1980; 14 (2): 128-34. NCBI toipunut.Nlm.NIH.Hallitus.
- Craig, k. (2018). Kaliforniassa käytettyjen rikidioksidin kemian, torjunta -aineiden käytön ja ympäristön kohtalon katsaus. Ympäristön saastumisen ja toksikologian katsauksissa. Volume 246. Linkki palautettu.Jousto.com.
- « Piilinitruro (Si3N4) rakenne, ominaisuudet, hankkiminen, käyttö
- Alumiinipolyloridirakenne, ominaisuudet, hankkiminen, käyttö »

