Referenssielektrodin ominaisuudet, toiminto, esimerkit
- 1074
- 87
- Kelly Kilback
Hän viiteelektrodi Se on laite, jota käytetään potentiometrisessä ja voltamétric -analyysissä analyytin kvantitatiiviseen määrittämiseen. Sen merkitys on, kuten nimestä päätetään.
Puoli -median potentiaalit riippuvat kiinnostuksen kohteena olevan ionin pitoisuudesta, koska se reagoi voittamalla tai menettämällä elektroneja. Tällä tavalla on mahdollista määrittää niiden keskittyminen näiden potentiaalien kautta. Niiden arvot eivät kuitenkaan ole absoluuttisia, vaan liittyvät tavanomaiseen vetyelektrodiin (hän englanniksi).
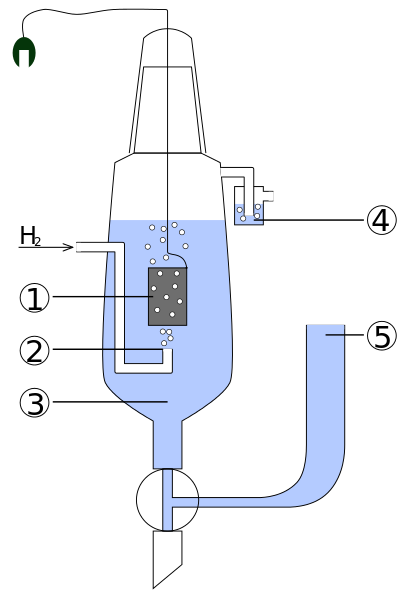
 Kaavio tavanomaisen vety -elektroin osista. Lähde: Standard_hydrogen_eleektrodi.JPG: Kaverinderivevatiivinen työ: Henry Muelpfordt/CC BY-S (http: // creativecommons.Org/lisenssit/by-SA/3.0/)
Kaavio tavanomaisen vety -elektroin osista. Lähde: Standard_hydrogen_eleektrodi.JPG: Kaverinderivevatiivinen työ: Henry Muelpfordt/CC BY-S (http: // creativecommons.Org/lisenssit/by-SA/3.0/) Valmistelukunnan mukaan vetyelektrodien potentiaalit ovat yhtä suuret kuin 0 V. Ongelmana on, että näitä elektrodeja on vaikea manipuloida, joten ne eivät ole käytännöllisiä asentaa niitä kaikissa analyyseissä. Täällä referenssielektrodit saapuvat, paljon yksinkertaisempia ja joiden potentiaali on erilainen kuin 0 V.
Jotkut vertailuelektrodit, kuten Calomelin tyydyttynyt elektrodi (ESC), voidaan rakentaa samaan laboratorioon ennen analyysin suorittamista. Samoin ne saadaan avoimesti markkinoilla asianmukaisilla eritelmillään, ja analyytin näytteen saastumisen riskit ovat minimaalisia.
[TOC]
Referenssielektrodin ominaisuudet
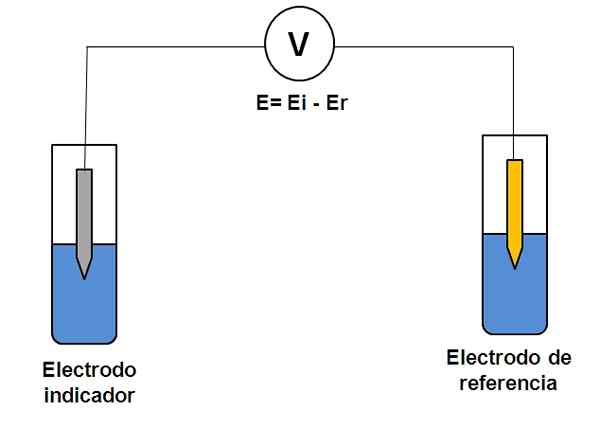 Kahden elektrodijärjestelmän yksinkertainen esitys potentiometriassa. Lähde: Gabriel Bolívar.
Kahden elektrodijärjestelmän yksinkertainen esitys potentiometriassa. Lähde: Gabriel Bolívar. Harkitse yllä olevaa kahta elektrodijärjestelmää. Yksi on indikaattori (harmaa), jossa kiinnostuksen reaktio tapahtuu, ja toinen on referenssi (kulta). Tällä sähkökemiakennolla on potentiaali ja mikä on yhtä suuri kuin molempien elektrodien potentiaalien ero (EI-E). Siksi minkä tahansa E: n vaihtelun on johdettava indikaattorielektrodin potentiaalista.
Voi palvella sinua: kaliumsyanidi (KCN): Ominaisuudet, käytöt, rakenteet, riskit,Yllä olevasta on päätelty, että vertailuelektrodilla on seuraavat ominaisuudet:
-Sillä on vakaa potentiaali ajassa ja se on toistettavissa. Eli sen tulisi olla sama riippumatta siitä, missä tai kuinka monta kertaa mittaukset tehdään.
-Sen kemiallinen koostumus on vakio ja tuntematon, joten tuskin tapahtuu muutoksia, kun se on vuorovaikutuksessa analyytin liuoksen kanssa tai upottaa itsensä vesipitoiseen väliaineeseen.
-Se on helppo rakentaa ja asentaa, toisin kuin tavallinen vetyelektrodi, joka vaatii vetysäiliön käyttöä ja käyttää räjähdysriskejä, kun vety sekoittuu ilman kanssa ilman kanssa.
Indikaattorielektrodi on herkkä analyytin pitoisuudelle.
Referenssielektroditoiminto
Vertailuelektrodien potentiaalit mitataan tavanomaista vetyelektrodia, joten niiden arvot eroavat 0 V. Näiden vetyelektrodien ansiosta standardin ja vakiopotentiaalitaulukoiden rakenne on mahdollista, jotka näkyvät redox -reaktioiden kemian teksteissä.
Käytännössä se ei kuitenkaan lataa vetyelektrodia kaikkialle. Sen sijaan käytetään vertailuelektrodeja, paljon yksinkertaisempia ja turvallisesti manipuloida.
Koska sen potentiaalit ovat vakioita ja vakaita, sähkökemiakennon potentiaaliset lukemat johtuvat yksinomaan indikaattorielektrodista; toisin sanoen kyseisen analyytin pitoisuuden vaihtelut.
Siten referenssielektrodifunktio on määrittää minkä tahansa reaktion potentiaali yhdessä sähkökemiallisen järjestelmän puolijalkojen puolella. Jos niiden potentiaalit eivät olisi vakaita, analyytin kvantitatiiviset määritykset eivät olisi luotettavia. Kaikkien potentiometristen tai voltametristen analyysien tulisi määrittää, mitä vertailuelektrodia he käyttivät tulosten ilmoittamiseen.
Se voi palvella sinua: bromihappo (HBRO2): fysikaaliset ja kemialliset ominaisuudet ja käyttääViiteelektrodit Esimerkkejä
Markkinoilla on useita saatavilla olevia referenssielektrodeja. Jotkut käytetään hyvin erityisiin määrityksiin. Niistä kaikista on kuitenkin kaksi elektrodia, jotka erottuvat niiden yksinkertaisuuden ja käytännöllisyyden ansiosta: kalomelielektrodi ja hopeahopea-clloride, molemmat toistuvat monissa potentiometrisissä ja voltamletrisissa analyyseissä.
Calomel -elektrodi
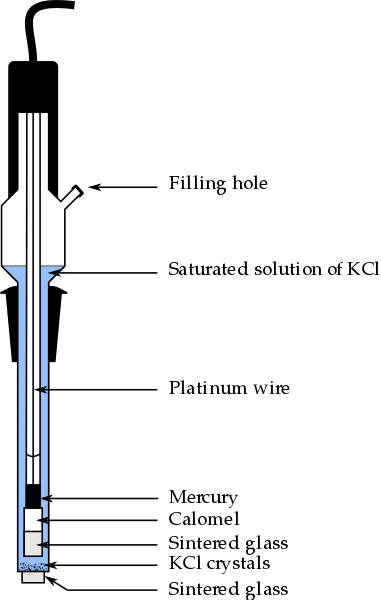 Calomel -elektrodin osat, yksi analyyttisen kemian eniten käytetyistä vertailuelektrodeista. Lähde: Bachi-Bouzouk Wikipedian kautta.
Calomel -elektrodin osat, yksi analyyttisen kemian eniten käytetyistä vertailuelektrodeista. Lähde: Bachi-Bouzouk Wikipedian kautta. Yläkuvassa esitetään tyydyttyneen kalomelielektrodin tavanomaiset osat, ECS. Sanotaan.
Sisäinen pylväs, jota kulkee platinajohdolla, on täytetty elohopealla, joka puolestaan koskettaa kalomelipastan, HG2Cl2 o elohopeakloridi (I) ja Kcl: n tyydyttynyt liuos. Siten tässä elektrodissa Cl -ionien pitoisuus on tärkeä-, Koska sen arvo muuttaa elektrodin potentiaalia.
Tapahtuva reaktio on seuraava:
Hg2Cl2(s) + 2e- ⇌ 2HG (L) + 2Cl-
Ja sen Eº on 0.241 V.
ECS: n alapäässä on huokoinen paistettu, joka asetetaan sähköiseen kosketukseen analyytin liuoksen kanssa ja mahdollistaa ioni -ionien valvonnan vaihdon-. Muutoin näytteessä olisi kloridien saastuminen, ja myös elektrodi menettäisi arvokkaan tyydyttyneen KCL -liuoksensa.
Tätä elektrodia käytetään pH -mittauksiin ja yleensä minkä tahansa analyytin kanssa, jonka konsentraatio voidaan määrittää vesipitoisessa väliaineessa.
Se voi palvella sinua: Lämpöalkoholi: rakenne, ominaisuudet, riskit ja käyttötarkoituksetHopeaelektrodi
 Hopeahopea elektro. Lähde: TenofallTrades (keskustelu) (lataukset). / Julkinen alue
Hopeahopea elektro. Lähde: TenofallTrades (keskustelu) (lataukset). / Julkinen alue Samoin kuin Calomelin elektrodi, hopeahopeaelektrodi koostuu hopeajohdosta, joka on peitetty hopeakloridilla, ja se on myös upotettu liuokseen, joka on kyllästynyt Kcl: n ja AgCl: n seoksella.
Kaikki sen osat on suojattu muoviputkessa, jolla on huokoinen aukko, jonka läpi se luo sähköisen kosketuksen liuoksen kanssa.
Reaktio, joka määrittelee sen potentiaalin, Eº = 0.197 V, on seuraava:
Agcl (s) + e- ⇌ Ag (s)+Cl-
Tämä elektrodi esittelee suurempia käyttötarkoituksia ja mieltymyksiä kuin Calomel, mikä johtuu elohopean kielteisestä vaikutuksesta ympäristöön. Toisaalta hopea-kiinteät hopeaelektrodit ovat yksinkertaisempia, turvallisempia ja halpoja rakentaa laboratorioon.
Sanomme silloin, että hopeahaarkan elektrodi korvaa Calomelin monissa sen sovelluksissa (potentiometriset asteet, korroosiokokeet, sähkökemiallinen analyysi jne.-A.
Se on myös yksi biologian ja lääketieteen edullisista vaihtoehdoista, etenkin elektrokardiografialle ja elektroenkefalografialle, koska hopea tai niiden suola ovat kehon suhteellisen myrkyllisiä aineita.
Viitteet
- Päivä, r., & Underwood, a. (1965). Kvantitatiivinen analyyttinen kemia. (Viides ed.-A. Pearson Prentice Hall.
- Skoog d.-Lla., Länsi D.M. (1986). Instrumentaalianalyysi. (Toinen Ed.-A. Amerikkalainen., Meksiko.
- Wikipedia. (2020). Elektrodiviite. Haettu: vuonna.Wikipedia.org
- Elsevier B.V. (2020). Elektrodiviite. Tiede. Haettu: ScienEdirect.com
- Kemian librettexts. (9. kesäkuuta 2020). Viiteelektrodit. Palautettu: Chem.Librettexts.org
- « Alexandrian majakka sijainti, historia, kuvaus, rauniot
- Emily Dickinsonin elämäkerta, saavutukset, teokset, lauseet »

