Ionisaatioenergia
- 3280
- 143
- Joshua Emmerich
Mikä on ionisaatioenergia?
Se ionisaatioenergia, Symbolin I edustama, se on vähimmäismäärä energiaa, joka tarvitaan ulkoisen elektronin käynnistämiseen atomien mooliin kaasumaisessa tilassa, sen perustilassa. Toisin sanoen, se on vähimmäismäärä energiaa, joka tarvitaan neutraalien atomien moolin muuttamiseen kaasumaiseksi tilaan ionien mooliksi positiivisella kuormalla (siis sen nimi).
Kemiallisen yhtälön muodossa ionisaatioenergia olisi seuraava prosessiin tarvittava energia:
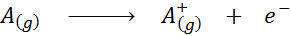
Ionisaatioenergia on suora mitta siitä, kuinka voimakkaasti kemiallisen elementin uloimmat elektronit on kytketty. Kun määritetään kaasumaisen tilan ionisaatioprosessin energiaa, vältetään molekyylien välisten vuorovaikutusten vaikutus tai häiriö.
Tällä tavalla varmistetaan, että ionisaatioenergia riippuu vain atomin sisäisistä voimista ja erityisesti kunkin elementin valenssikerroksen muodostavien elektronien stabiilisuudesta.
Elektronin poistamisprosessi Valencia -kerroksesta on prosessi, joka vaatii energiaa, joten se on endoterminen prosessi. Tästä syystä ionisaatioenergiat ovat aina positiivisia (yleissopimuksen mukaan, kun energia tulee järjestelmään pidetään positiivisena).
Ionisaatioenergiaa on enemmän kuin yksi
Vaikka ionisaatioenergian määritelmää sovelletaan neutraaleihin atomeihin, joista tulee positiivisia ioneja (ts. Kationeja), sitä voidaan soveltaa myös positiivisten ionielektronien peräkkäiseen poistamiseen, ts. Lajeja, jotka jo ne ovat jo menettäneet elektroneja.
Tässä mielessä neutraalin atomin ionisoinnin energiasta tulee vain ensimmäinen monista mahdollisista ionisaatioenergioista, koska jokaiselle ytimen ympärille kiertävälle elektronille on yksi.
Voi palvella sinua: mitkä ovat liikkeen elementit?Toisin sanoen kaikkiin seuraaviin prosesseihin liittyvät energiat pidetään ionisaatioenergioina:
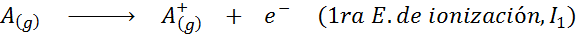
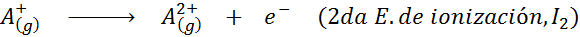
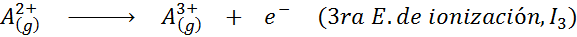
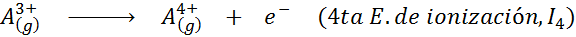
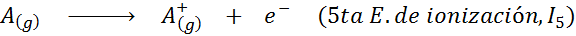
Peräkkäisten ionisaatioenergioiden järjestys
Minkä tahansa elementin atomiin on täytettävä, että ionisaatioenergia on aina suurempi kuin kaikki aiemmat ionisaatioenergiat. Toisin sanoen peräkkäisillä ionisaatioenergioilla on seuraava suhde:
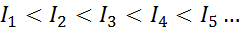
Syy siihen, miksi tämä tapahtuu, on hyvin yksinkertainen. Ensimmäinen ionisaatioenergia sisältää elektronin poistamisen neutraaliin atomiin. Toinen ionisaatioenergia merkitsee kuitenkin elektronin ottamista atomiin, joka on jo menettänyt ensimmäisen.
Elektronin puuttuminen jättää positiivisen nettokuorman, joka houkuttelee enemmän lujuutta jäljellä olevia elektroneja, joten niiden aloittaminen on vaikeampaa. Lisäksi tämä poissaolo vähentää myös elektronien suojasta uloimpiin elektroneihin, joten ydin kykenee houkuttelemaan niitä voimakkaammin.
Tuloksena on, että toisen elektronin aloittaminen on vaikeampaa kuin ensimmäinen, ja kolmannen aloittaminen on vaikeampaa kuin toinen ja niin edelleen, kuten seuraavassa ionisaatioenergiataulukossa voidaan nähdä ensimmäisen kymmenen elementin seuraavassa ionisaatioenergiataulukossa taulukon määräajoin.
Z -z | Elementti | Ensimmäinen | Toinen | Kolmas | Neljännes | Viides | Kuudes |
1 | H | 1312 | |||||
2 | Hän | 2373 | 5251 | ||||
3 | Li | 520 | 7300 | 11815 | |||
4 | Olla | 899 | 1757 | 14850 | 21005 | ||
5 | B - | 801 | 2430 | 3660 | 25000 | 32820 | |
6 | C | 1086 | 2350 | 4620 | 6220 | 38000 | 47261 |
7 | N | 1400 | 2860 | 4580 | 7500 | 9400 | 53000 |
8 | JOMPIKUMPI | 1314 | 3390 | 5300 | 7470 | 11000 | 13000 |
9 | F | 1680 | 3370 | 6050 | 8400 | 11000 | 15200 |
10 | NE | 2080 | 3950 | 6120 | 9370 | 12200 | 15000 |
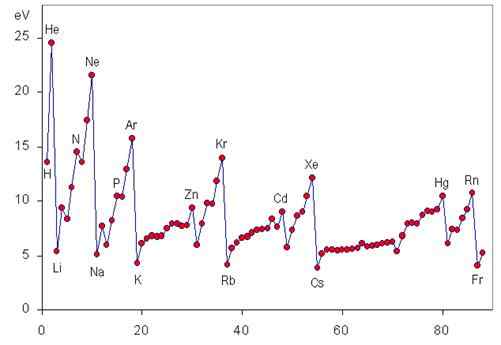
Ionisaatioenergian säännöllinen suuntaus
Ionisaatioenergia on jaksollinen ominaisuus, joka kasvaa vasemmalta oikealle ja alhaalta jaksoon, kuten seuraavassa grafiikassa voidaan nähdä.
Voi palvella sinua: Lineaarinen laajentuminen: Mikä se on, kaava ja kertoimet, esimerkki
I: n vaihtelu ajanjakson aikana
Kun siirrymme ajanjakson ajan vasemmalta oikealle, kutsutaan jonkin verran tehokkaasti ydinkuormitusta, mikä ei ole muuta kuin todellinen positiivinen kuorma, jonka uloimmat elektronit voivat "nähdä" johtuen kaikkein sisäisten elektronien suojasta.
Tämä tarkoittaa, että voima, jolla ydin kykenee houkuttelemaan Valencian elektroneja, kasvaa, joten on vaikeampaa repiä ne ja vaadittu energia (ts. Ionisaatioenergia) tulee suuremmaksi.
I: n variaatio koko ryhmässä
Kun ryhmässä laskeutuu, asetamme elektroneja kasvavilla energiatasoilla ja siksi atomiorbitaaleissa yhä enemmän ytimestä. Tästä syystä voima, jolla ydin houkuttelee valenssielektroneja.
Kuinka määrittää ionisaatioenergiaa?
Ionisaatioenergia on kokeellisesti tietty määrä tekniikan sarjan, nimeltään yhdessä, fotoelektronispektroskopia.
Nämä tekniikka.
Fotoelektronispektroskopian erilaiset tekniikat mahdollistavat analysoinnin energioiden analysoimiseksi, jonka käytännössä mikä tahansa elektroni on kytketty sen ytimeen, onko Valencian elektroni vai sisäinen elektroni.
Esimerkkejä ionisaatioenergiasta
Noble -kaasujen ensimmäiset ionisaatioenergiat
Noble -kaasuilla on vakaimmat elektroniset kokoonpanot kaikista jakson taulukon elementeistä. Tästä syystä heillä on myös suurin ionisaatioenergiat. Kunkin jalokaasun ensimmäinen ionisaatioenergia on esitetty alla:
-
Helium
Sen ensimmäinen ionisaatioenergia on 2373 kJ/mol, korkein koko jaksollisessa taulukossa.
-
Neon
Sen ensimmäinen ionisaatioenergia on 2080 kJ/mol ja on toiseksi korkein.
-
Argoni
Sen ensimmäinen ionisaatioenergia on 1521 kJ/mol. Vain F, NE: llä ja hänellä on suurempia ionisaatioenergioita.
-
Kripton
Ensimmäinen ionisaatioenergia on 1350 kJ/mol. Se ei ole niin korkea kuin muut, mutta se on silti suurempi kuin naapurimaiden elementtien.
-
Ksenoni
Sama asia, joka sanotaan Kriptonista, voidaan sanoa ksenonista sen ensimmäisen ionisaatioenergian ollessa 1170 kJ/mol.
Voi palvella sinua: Matoreikä: historia, teoria, tyypit, muodostuminenAlkalimetallien ensimmäinen ja toinen ionisaatioenergia
Alkalimetallit ovat puolestaan pienintäkään ensimmäinen ionisaatioenergia ja kaikkien elementtien suurin toinen ionisaatioenergia:
-
Litium
Sen ensimmäinen ionisaatioenergia on alle neljäsosa HE: n energiasta, mutta litiumilla on kaikkien elementtien suurin toinen ionisaatioenergia, joka on 7300 kJ/mol.
-
Natrium
Natrium menettää ensimmäisen elektroninsa erittäin helposti, koska se hankkii NE: n elektronisen kokoonpanon, mutta toisen elektronin poistamiseksi sinun on toimitettava 4560 kJ/mol.
-
Kalium
Ensimmäinen kaliumionisaatioenergia on vain 418,7 kJ/mol, kun taas toinen on 3052 kJ/mol, huomattavasti suurempi kuin naapureidensa.
-
Rubidium
Ionisaatioenergialla 403 kJ/mol, Rubidio on yksi elementeistä, joilla on vähemmän ionisaatioenergiaa. Toinen on kuitenkin 2633 kJ/mol.
-
Cesium
Sen ensimmäinen ionisaatioenergia on vain 375 kJ/mol ja toinen 2234 kJ/mol, jopa alhaisempi kuin ensimmäinen heliumionisaatioenergia.

