Kovalenttisidos
- 4905
- 1198
- Louis Moen
Mikä on kovalenttinen linkki?
Kovalenttinen sidos on vahva vuorovaikutus, joka antaa kahden tai useamman atomin liittyä molekyyleiden muodostamiseksi. Tämä on yksi kemiallisista sidoksista, joihin pari elektronia osallistuu linkitettyjen atomien uloimmista kiertorajoista.
Teoriassa kukin atomi antaa yhden kahdesta elektronista yhdistettäessä kovalenttisesti niin, että ne voittavat vakauden. Elektronipari, josta tulee eräänlainen ”elektroninen koukku” kahden atomiytimen välillä, jaetaan tasaisesti kahden identtisen atomin kesken, mutta näin ei tapahdu, kun kaksi atomia ovat kahta eri elementtiä.
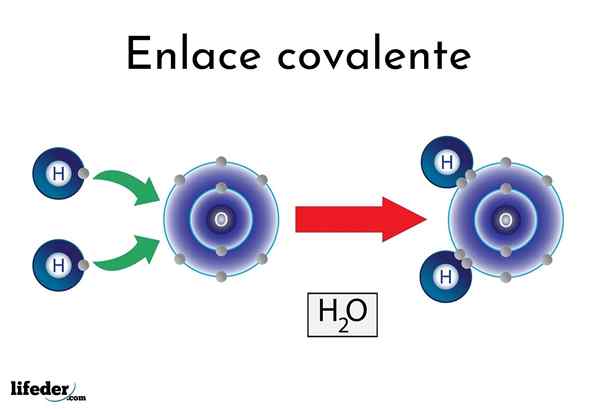
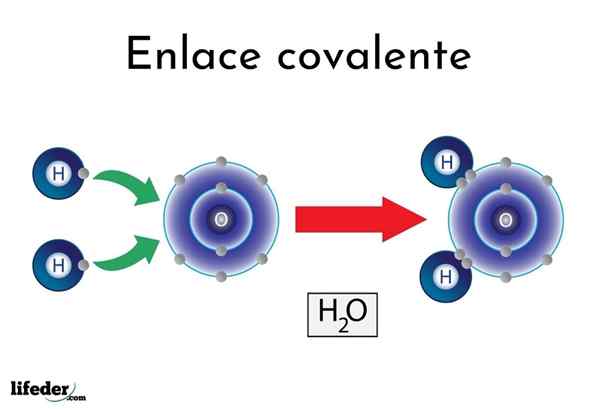 Vesisidos
Vesisidos On atomeja tai elementtejä, joilla on luonnollinen taipumus tuottaa elektroneja, kun taas toiset mieluummin voittavat ne.
Esimerkiksi kuuluisa vesimolekyyli, H2Tai siinä on kaksi kovalenttisia linkkejä: H-O-H. Hydrogeenit ja happi jakavat kaksi paria elektronia, mutta nämä kiertoradat lähempänä happiatomia kuin vety. Tämä ilmiö johtuu napaisuudesta ja elektronegatiivisuudesta.
Kovalenttisten sidosten ominaisuudet
Kovalenttiset sidokset esittävät seuraavat ominaisuudet:
-Niihin liittyy pari elektronia jokaiselle kovalenttiselle sidokselle.
-Sen pituudet ilmaistaan yleensä PM (pikometrit) tai Armstrong (Å) -yksiköissä.
-Niitä on vaikea rikkoa, mikä tarkoittaa, että he ovat erittäin vahvoja.
-Kun ne rikkoutuvat, kemiallisia muutoksia tai muunnoksia tapahtuu, koska molekyyli menettää atomeja. Tässä prosessissa energia imeytyy.
-Kun ne muodostavat, syntyy uusi molekyyli. Tässä prosessissa energia vapautuu.
Voi palvella sinua: Kemialliset reaktiot: Ominaisuudet, osat, tyypit, esimerkit-Sen pituudet vaihtelevat sen aviditeetin mukaan, että yhdellä kytkettyistä atomista on elektronipari; Toisin sanoen, mitä enemmän se houkuttelee sitä, kovalenttinen linkki pidentyy.
-Yksinkertaisimmat kovalenttiset sidokset esiintyvät vain kahden atomin välillä samanaikaisesti, ja ne esitetään käsikirjoituksella tai rivillä (-).
On muitakin ominaisuuksia, jotka koskevat monimutkaisempia kovalenttisia linkkejä, jotka ovat kuitenkin myös yllä kommentoidut.
Tyypit kovalenttiset linkit
Kovalenttiset sidokset voidaan periaatteessa luokitella kahdella tavalla: jaettujen elektronien lukumäärän mukaan ja siitä johtuvan napaisuuden mukaan molekyylin muodostuessa. Molemmat kuvataan pinnallisesti alla.
Jaettujen elektronien lukumäärän mukaan
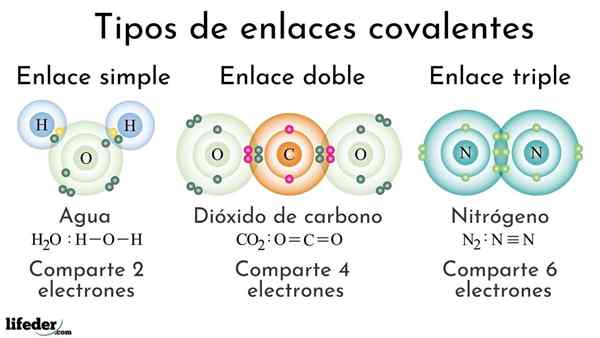 Kovalenttisia sidostyyppejä jaettujen elektronien lukumäärän mukaan
Kovalenttisia sidostyyppejä jaettujen elektronien lukumäärän mukaan Kovalenttiset sidokset jaettujen elektronien lukumäärän mukaan voidaan luokitella yksinkertaiseksi, kaksinkertaiseksi tai kolminkertaiseksi. Yläkuvassa nämä vastaavat linkit kolmelle molekyylille, joita käsitellään alla.
-
Yksinkertainen
Yksinkertainen kovalenttinen sidos on sellainen, jossa on vain pari elektronia, ts. Kaksi elektronia. Esimerkki tästä linkistä, jonka näemme vesimolekyylissä, H2JOMPIKUMPI. Huomaa, että kaikista kovalenttisista sidoksista yksinkertainen, i-i, on pisin kaikista. Tämä on melkein aina.
-
Kaksinkertainen
Kaksinkertaisessa kovalenttisessa sidoksessa, kuten nimestä voi päätellä.
Eli kaksoissidos (=) on vahvempi kuin yksinkertainen (-). Se on kuitenkin reaktiivisempaa, mikä voi vaikuttaa ristiriitaiselta, on helppo selittää atomiorbitaalien päällekkäisyyksien perusteella.
Voi palvella sinua: napaisuus (kemia): Mikä on, määritelmä, esimerkitEsimerkki tästä linkistä näkyy hiilidioksidimolekyylissä, CO2. Kaksi happiatomia pysyvät voimakkaasti yhdistyneinä hiileen tämän sidoksen ansiosta tai = c = o, joka on vahvempi lähempänä atomeja; Ja puolestaan tämä johtaa siihen, että linkki lyhenee.
-
Kolminkertaistaa
Kolminkertainen linkki on vahvin ja lyhin kovalenttisia sidoksia (yleisiä). Huomaa, että typpimolekyylissä n2 tai nÖn, niiden atomit, joita edustavat sinertävät pallot, ovat hyvin lähellä toisiaan.
Kolminkertaisessa linkissä meillä on kolme elektroniparia, jotka ovat yhtä suuret kuin kuusi elektronia, jotka vahvistavat kovalenttisen sidoksen kahden atomin välillä.
-
Datiivi
Dative -linkki on erityinen yksinkertainen linkki, joka koostuu elektroniparista, tulee vain yhdestä kahdesta kytkettystä atomista. Toisin sanoen sitä voidaan pitää "pakotettuna jakamisena".
Esimerkiksi M -molekyyli2Tai käytä yhtä happea -vapaat parit luovuttaaksesi ne ionille H: lle+ (H2O: → H+ = [H2VAI NIIN]+ tai h3JOMPIKUMPI+-A.
Polaarisuuden mukaan
Kovalenttiset sidokset napaisuuden mukaan voidaan luokitella polaariseksi kovalentiksi tai ei -polaariseksi kovalentiksi.
-
Polaariset kovalenttiset sidokset
Se tapahtuu kahden eri atomin välillä, joiden elektronegatiivisuusero on suuri. Tämä johtaa dipolin muodostumiseen, jossa atomi konsentroi negatiivisesti (houkuttelee elektroneja), kun taas muut konsentraatit positiivisesti (tuottaa elektroneja). Esimerkiksi HF (H-F) -kovalenttinen sidos on polaarinen, koska fluoridi on enemmän elektronegatiivista kuin vety.
-
Ei -polaariset kovalenttiset linkit
Se esiintyy kahden identtisen atomin välillä, joiden ero elektronegatiivisuudessa on nolla tai hyvin pieni. Edellä mainitut molekyylit: i2, JOMPIKUMPI2 ja n2 He esittävät ei -polaarisia kovalenttisia sidoksia. Siksi elektronit ovat molempia atomeja, joilla on sama taajuus.
Se voi palvella sinua: uretaani: rakenne, ominaisuudet, hankkiminen, käyttöEsimerkkejä kovalenttisia linkkejä
Lopuksi, muut kovalenttiset joukkovelkakirjat luetellaan jo selitettyjen lisäksi, mikä osoittaa myös niiden tyypit:
H2S (H-S-H), yksinkertainen polaarinen kovalenttinen | HCl (H-CL), Polar Simple Covalent Link |
H2 (H-H), ei polaarinen yksinkertainen kovalenttinen | C2H4 (H-C≡C-H), kahdella yksinkertaisella polaarilinkillä (C-H) ja kolminkertaisella ei-polaarisella linkillä (C≡C) |
F2 (F-F), yksinkertainen ei-polaarinen kovalenttinen | P2 (P≡P), ei -polaarinen (tai apolaarinen) kovalenttinen sidos |
Co₂ (o = c = o), kaksinkertainen polaarinen kovalenttinen | S2 (s = s), ei -polaarinen kaksoiskovalenttinen sidos |
HCN (H-C≡N), yksinkertaisella polaarisella kovalenttisella sidoksella (H-C) ja toisella kolminkertaisella polaarisella linkillä (c≡N) | NH3 (N-H), kolmella yksinkertaisella polaarisella kovalenttisella sidoksella |
Mainitut esimerkit vastaavat pieniä molekyylejä. Mutta kovalenttisia sidoksia on läsnä kaikissa olemassa olevissa molekyyleissä, mukaan lukien polymeerit, biomolekyylit, makromolekyylit, mineraalit, keramiikkat, hiilivedyt, muun muassa.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- María Estela Raffino. (28. kesäkuuta 2020). Kovalenttisidos. Konsepti.-. Toipunut: Konsepti.-
- Wikipedia. (2020). Kovalenttisidos. Haettu: vuonna.Wikipedia.org
- Camy Fung & Nima Mirzaee. (15. elokuuta 2020). Kovalenttiset sidokset. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D -d. (27. elokuuta 2020). Mikä on kovalenttinen sidos kemiassa? Toipunut: Admingco.com

