Ei -polaarinen kovalenttinen sidos
- 1061
- 219
- Joshua Emmerich
Selitämme, mikä ei -polaarinen kovalenttinen sidos on, sen ominaisuudet ja useita esimerkkejä
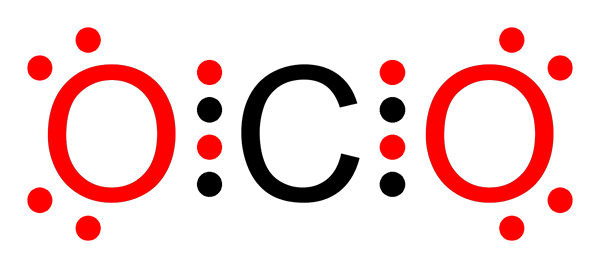
 Hiilidioksidin ei -polaarinen kovalenttinen sidos
Hiilidioksidin ei -polaarinen kovalenttinen sidos Mikä on ei -polaarinen kovalenttinen sidos?
Eräs ei -polaarinen kovalenttinen sidos, Kutsutaan myös puhdasta tai apolaarista kovalenttisia sidoksia, se on kaksi atomia, joilla on yksi tai useampi elektroniparia. Toisin sanoen.
Tämäntyyppinen linkki on kahden yhtä suuren atomin (samasta elementti) tai kahden eri atomin välillä, mutta joilla on hyvin samanlaisia elektronegativiteetteja.
Kemiallisia linkkejä on kolme tyyppiä, jotka pitävät atomit yhdessä keskenään. Nämä ovat: ioninen sidos, kovalenttinen sidos ja metallinen linkki. Nämä linkit eroavat siitä, kuinka elektronit jakautuvat atomien ympärille.
Kovalenttisten sidosten tapauksessa kahdella atomilla on valenssielektronit, mikä tarkoittaa, että nämä elektronit pyörivät atomin ympärillä. Tämä ei kuitenkaan ole aina oikeudenmukaista, koska elektronit mieluummin viettävät enemmän aikaa lähellä elektronegatiivista atomia, mikä johtaa polaariseen kovalenttiseen sidokseen.
Ei -polaaristen kovalenttisten sidosten tapauksessa tätä ei tapahdu, koska molemmilla atomilla on sama elektronegatiivisuus tai hyvin samanlainen elektronegativiteetti.
Ei -polaarisen kovalenttisen linkin ominaisuudet
1. Ne muodostuvat atomien välillä, joilla on yhtäläiset tai hyvin samanlaiset elektronegatiivisuudet
Ne ovat kovalenttisia linkkejä, jotka muodostavat yhtä suuret atomien välillä tai joilla on hyvin samanlaisia elektronegativiteetteja. Yleensä kovalenttisen sidoksen ei pidetä polaarina, jos elektronegativiteettiero on pienempi tai yhtä suuri kuin 0,4.
Voi palvella sinua: sucniinihappo: rakenne, ominaisuudet, hankkiminen, käyttö2. Ne voivat olla yksinkertaisia, kaksinkertaisia tai kolminkertaisia
Elektroniparien lukumäärästä riippuen, jotka molemmat atomilla on, ei -polaariset tai apolaariset kovalenttiset sidokset voivat olla yksinkertaisia, kaksinkertaisia tai kolminkertaisia.
Kun sidos muodostuu yhdellä elektroniparilla, sitä kutsutaan yksinkertaiseksi linkkiksi, kun kaksi elektroniparia jaetaan, sitä kutsutaan kaksoissidokseksi, ja jos kolme elektroniparia jaetaan, sitä kutsutaan kolminkertaiseksi linkille.
3. Ne liittyvät melkein aina ei -metalleihin
Metallit ovat elementtejä, joilla on erittäin matala elektronegativiteetti, jotka muodostavat metallilinkkejä toisiinsa. Kun ne on kytketty muihin kuin -metalleihin, ne muodostavat aina joko ioniset sidokset tai polaariset linkit. Tästä syystä ei -polaariset kovalenttiset sidokset muodostuvat vain ei -metallisiin elementteihin, kuten vety ja hiili.
4. Ne aiheuttavat apolaarisia yhdisteitä
Yhdiste, jolla on vain ei -polaarisia kovalenttisia sidoksia, muodostuu apolaariset molekyylit. Tämän tyyppisille yhdisteille on ominaista, että niillä on alhaiset kiehumis- ja fuusiopisteet verrattuna metalleihin ja ionisiin yhdisteisiin (jotkut ovat jopa kaasuja huoneenlämpötilassa), ne ovat liukenemattomia veteen ja ovat huonoja lämmön ja sähkön johtimia.
5. Ne voivat muodostaa kiinteitä, nestemäisiä tai kaasumaisia yhdisteitä huoneenlämpötilassa
Yhdisteissä, joissa ei ole polaarisia kovalenttisia sidoksia.
Tämän vuoksi jotkut niistä ovat kaasuja huoneenlämpötilassa (kuten vety, H2, ja typpi, n2), toiset ovat nesteitä (kuten bromi, br2), kun taas toiset ovat vankkoja (kuten naftaleeni, c10H8-A.
6. Heillä on suhteellisen alhaiset linkkienergiat.
Ionilinkkiin verrattuna, ei -polaariset kovalenttiset sidokset on helpompi rikkoa, koska niillä on alhaisempi linkkienergia. Tämä tarkoittaa, että sinun on käytettävä vähemmän energiaa rikkoaksesi ei -polaarisen kovalenttisen sidoksen kuin ioninen sidos.
Voi palvella sinua: Stoikiometriset laitEsimerkkejä ei -polaarisista kovalenttisia linkkejä
H-H-linkki vetymolekyylissä (H2-A
Vetymolekyylissä H2, Kahdella vetyatomilla on ainoat valenssielektronit yksinkertaisen kovalenttisen sidoksen muodostamiseksi.
 Vetymolekyyli
Vetymolekyyli Koska molemmat atomit ovat samat, näiden kahden välisen elektronegatiteetin ero on nolla, joten tämä linkki on ei -polaarinen kovalenttinen sidos.
F-F-linkki fluorimolekyylissä (F2-A
Tämä esimerkki korostaa sitä tosiasiaa, että sillä ei ole merkitystä atomin elektronegatiivisuudesta, vaan kahden atomin elektronegatiivisuuden ero, joka muodostaa linkin tietää, onko linkki kovalenttinen, ei napa vai ei.
 Fluorimolekyyli
Fluorimolekyyli Fluori on jaksollisen taulukon elektronegatiivisin elementti, joten sillä on taipumus poistaa elektronit muista elementeistä muodostaakseen polaarisia tai ionisia sidoksia.
Kuitenkin, kun fluori -atomi on kytketty toiseen kuin hän, ei voi poistaa elektroneja toisesta (elektronegatiivisuudessa ei ole eroa), joten heillä ei ole muuta vaihtoehtoa kuin jakaa ne tasapuolisesti ja muodostaa siten, siten muodostuu, a, a ei -polaarinen kovalenttinen linkki.
O-O-linkit otsonimolekyylissä (tai3-A
Kuten fluorimolekyylin tapauksessa, happi on myös erittäin elektronegatiivinen elementti. Kuitenkin muodostamalla yhteydet muihin happiatomeihin, se muodostaa ei -polaariset kovalenttiset sidokset. Näin on otsonimolekyylin tapauksessa.
 Otsonimolekyyli
Otsonimolekyyli Tässä tapauksessa keskushappiatomi on kytketty kahteen muuhun happiatomiin ei -palaaristen tai apolaaristen kovalenttisten sidosten avulla.
Voi palvella sinua: Magnesiumoksidi: rakenne, ominaisuudet, nimikkeistö, käyttöN-N-linkki typpimolekyylissä (n2-A
Typpimolekyyli sisältää ei -polaarisen kovalenttisen sidoksen, jossa jokaisella typpiatomilla on sen kolme valenssielektronia kadonnut toisen kanssa.
 Typpimolekyyli
Typpimolekyyli Tästä syystä molemmilla atomilla on yhteensä kolme paria elektronia, jolloin muodostavat kolminkertaisen kovalenttisen sidoksen.
C-H-linkit metaanimolekyylissä (CH4-A
Metaani on esimerkki ei -polaarisesta kovalenttisesta sidoksesta, joka muodostuu eri elementtien atomien, tässä tapauksessa hiilen ja vedyn välillä.
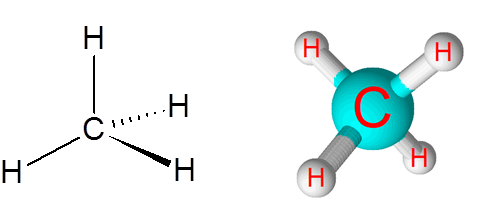 Metaanimolekyyli
Metaanimolekyyli Kahden elementin elektronegatiivisuuden ero on 0,4, mikä asettaa tämän reunan vain polaaristen ja polaaristen sidosten väliin.
Linkki C = C eteenimolekyylissä (C2H4-A
Eteenimolekyylillä, jota kutsutaan myös Etenoksi, on yhteensä viisi linkkiä. Neljä C-H-linkkiä ja kaksoissidos C = C. Molemmissa tapauksissa linkit vastaavat ei -polaarisia tai apolaarisia kovalenttisia sidoksia.
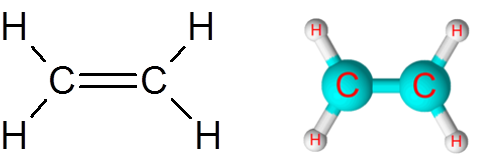 Etyleenimolekyyli
Etyleenimolekyyli
- « 6 tanssia ja tanssia, jotka ovat tyypillisiä Quintana Roo lle kuuluisemmin
- Michoacánin 9 tanssia ja tyypillistä tanssia kuuluisemmin »

