Polar Covalent Link -ominaisuudet ja esimerkit
- 2617
- 102
- Juan Breitenberg V
Eräs Polaarinen kovalenttisidos Se on muodostettu kahden kemiallisen elementin välillä, joiden elektronegatiivisuusero on huomattava, mutta lähestymättä puhtaasti ionista luonnetta. Se on siten väliaikainen vahva vuorovaikutus apolaaristen kovalenttisten sidosten ja ionisten linkkien välillä.
Sanotaan, että se on kovalenttinen, koska teoriassa kahden kytkettyjen atomien välillä on tasapuolinen jakaminen; eli kaksi elektronia jaetaan tasaisesti. Atomi E · lahjoittaa elektronin, kun taas · x tarjoaa toisen elektronin kovalenttisen sidoksen E: X tai E-X muodostamiseksi.
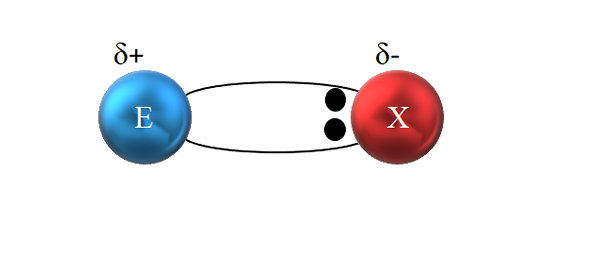
 Polaarisessa kovalenttisessa sidoksessa elektroniparia ei jaeta tasapuolisesti. Lähde: Gabriel Bolívar.
Polaarisessa kovalenttisessa sidoksessa elektroniparia ei jaeta tasapuolisesti. Lähde: Gabriel Bolívar. Kuten ylemmästä kuvasta nähdään, nämä kaksi elektronia eivät kuitenkaan sijaitse E: n ja X: n keskustassa, mikä osoittaa, että ne "kiertävät" samalla taajuudella molempien atomien välillä; mutta ovat lähempänä x: tä kuin E. Tämä tarkoittaa, että X on houkutellut elektroniparin itseensä sen suuremman elektronegatiivisuuden vuoksi.
Koska linkin elektronit ovat lähempänä x: tä kuin E, noin x: n ympärillä on korkea elektronisen tiheyden alue, Δ-; Kun taas E -alueella esiintyy elektroneja, δ+. Siksi sähkövaraukset polarisaatio: polaarinen kovalenttinen sidos.
[TOC]
Ominaisuudet
Napaisuusasteet
Kovalenttisia sidoksia on luonteeltaan erittäin runsaasti. Niitä on käytännössä läsnä kaikissa heterogeenisissä molekyyleissä ja kemiallisissa yhdisteissä; Koska loppujen lopuksi se muodostuu, kun kaksi erilaista atomia E ja X on linkitetty. Polaarisia kovalenttisia sidoksia on kuitenkin enemmän kuin muut, ja saadaksesi selville, että sinun on turvauduttava elektronegativiteettiin.
Kuinka paljon enemmän elektronegatiivista on x ja vähemmän elektronegatiivista e e (elektropositiivinen), sitten tuloksena oleva kovalenttinen sidos on polaarisempi. Tavanomainen tila tämän napaisuuden arvioimiseksi on kaavan kautta:
Voi palvella sinua: natriumborohydridi (NABH4): rakenne, ominaisuudet, käyttötarkoituksetχX - χJA
Missä χ on kunkin atomin elektronegatiivisuus Pauling -asteikon mukaan.
Jos tämän vähennyksen tai vähennyksen arvot ovat välillä 0,5 - 2, se on polaarinen linkki. Siksi on mahdollista verrata polaarisuuden astetta useiden E-X-linkkien välillä. Jos saatu arvo on korkeampi kuin 2, puhuu ionisesta linkistä ja+X- Ja se ei oleΔ+-XΔ-.
E-X-linkin napaisuus ei kuitenkaan ole ehdoton, vaan riippuu molekyyliympäristöistä; Toisin sanoen molekyylissä -e-x-, jossa E ja X muodostavat kovalenttisia sidoksia muiden atomien kanssa, jälkimmäinen vaikuttaa suoraan siihen napaisuusasteeseen.
Niistä peräisin olevat kemialliset elementit
Vaikka E ja X voivat olla mikä tahansa elementti, kaikki eivät ole peräisin polaarisia kovalenttisia sidoksia. Esimerkiksi, jos E on erittäin elektropositiivinen metalli, kuten alkalinen (Li, Na, K, RB ja CS) ja x Halogeen (F, Cl, BR ja I), niillä on taipumus muodostaa ionisia yhdisteitä (NA+Cl-) eikä molekyylit (Na-Cl).
Siksi polaariset kovalenttiset sidokset ovat yleensä kahden ei -metallisen elementin välillä; ja vähemmässä määrin ei -metallisten elementtien ja joidenkin siirtymämetallien välillä. Nähdä lohko p Määräaikaisesta taulukosta on monia vaihtoehtoja tämän tyyppisten kemiallisten linkkien muodostamiseksi.
Napa- ja ioninen luonne
Suurissa molekyyleissä ei ole tärkeää miettiä, kuinka polaarinen linkki on; Nämä ovat erittäin kovalenttisia, ja niiden sähkövarausten jakautuminen (missä ovat elektronien rikkaat tai köyhät alueet) on enemmän huomiota niiden sisäisten linkkien kovalenssin määrittelemiseen.
Voi palvella sinua: kaasukromatografiaKuitenkin pitalialla tai pienillä molekyyleillä, sanoi napaisuus jaΔ+-XΔ- Se on melko suhteellinen.
Tämä ei ole ongelma molekyyleissä, jotka on muodostettu ei -metallisten elementtien välillä; Mutta kun siirtymävaihe tai metalloidimetallit osallistuvat, ei enää puhu vain polaarisesta kovalenttisesta sidoksesta, vaan kovalenttisesta sidoksesta tietyn ionisen luonteen kanssa; ja siirtymämetallien tapauksessa kovalenttinen koordinaatioyhteys.
Polar Covalent Bond -esimerkit
Yhteistyö
Hiilen ja hapen välinen kovalenttinen sidos on polaarinen, koska ensimmäinen on vähemmän elektronegatiivinen (χC = 2,55) että toinen (χJOMPIKUMPI = 3,44). Siksi, kun näemme linkit c-o, c = o o c-o-, Tiedämme, että ne ovat polaarisia linkkejä.
H-X
Vetyhalogenidit, HX, ovat ihanteellisia esimerkkejä polaarisidoksen ymmärtämiseksi niiden diatomisissa molekyyleissä. Vety elektronegatiivisuus (χH = 2,2), voimme arvioida, kuinka polaariset nämä halogeenurot ovat:
-HF (H-F), χF (3,98) - χH (2,2) = 1,78
-HCl (H-Cl), χCl (3,16) - χH (2,2) = 0,96
-HBR (H-BR), χBr (2,96) - χH (2,2) = 0,76
-Hei (h-i), χYllyttää (2,66) - χH (2,2) = 0,46
Huomaa, että näiden laskelmien mukaan H-F-linkki on polaarisin kaikista. Nyt se, mikä on sen ioninen hahmo, joka ilmaistaan prosentteina, on toinen aihe. Tämä tulos ei ole yllättävä, koska fluori on kaikkien elektronegatiivisin elementti.
Kun elektronegatiivisuus laskeutuu kloorista jodiin, H-Cl, H-BR- ja H-I-linkit muuttuvat vähemmän polaariksi. H-I-linkin tulisi olla apolaarinen, mutta todellisuudessa se on polaarinen ja myös erittäin "hauras"; rikkoutuu helposti.
Voi palvella sinua: Elohopeahydroksidi: rakenne, ominaisuudet, käytöt, riskitVAI NIIN
Polar O-H -yhteys voi olla tärkein: kiitos hänelle, koska hän tekee yhteistyötä veden dipolimomentin kanssa. Jos arvioimme eroa hapen ja hydrogenssien elektronegatiteetin välillä, meillä on:
χJOMPIKUMPI (3,44) - χH (2,2) = 1,24
Vesimolekyyli, H2Tai siinä on kaksi näistä linkeistä, h-o-h. Tämä, ja molekyylin kulmageometria ja sen epäsymmetria tekevät siitä erittäin polaarisen yhdisteen.
N-H-H-H-
N-H-linkki on läsnä proteiiniryhmissä. Toistamalla sama laskelma, joka meillä on:
χN (3,04) - χH (2,2) = 0,84
Tämä heijastaa sitä, että N-H-linkki on vähemmän napainen kuin O-H (1,24) ja F-H (1,78).
Ruma
Fe-O. Katsotaanpa, onko se polaarisempaa kuin h-o:
χJOMPIKUMPI (3,44) - χUsko (1,83) = 1,61
Tästä eteenpäin perustellusti oletetaan, että Fe-O-linkki on polaarisempi kuin H-O-linkki (1,24); tai mikä on sama kuin sanominen: Fe-O: lla on suurempi ioninen luonne kuin H-O.
Nämä laskelmat näyttävät polaarisuuden astetta useiden linkkien välillä; Mutta ne eivät riitä hallitsemaan, onko yhdiste ioninen, kovalenttinen vai sen ioninen luonne.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Laura Nappi. (2019). Polaariset ja ei -polaariset kovalenttiset sidokset: määritelmät ja esimerkki. Opiskelu. Toipunut: Opiskelu.com
- Helmestine, Anne Marie, PH.D -d. (18. syyskuuta 2019). Polaarisidoksen määritelmä ja esimerkki (polaarinen kovalenttinen sidos). Toipunut: Admingco.com
- Elsevier B.V.(2019). Polaarinen kovalenttisidos. Tiede. Haettu: ScienEdirect.com
- Wikipedia. (2019). Kemiallinen napaisuus. Haettu: vuonna.Wikipedia.org
- Tuntematon. (5. kesäkuuta 2019). Polaaristen kovalenttisten sidosten ominaisuudet. Kemian librettexts. Palautettu: Chem.Librettexts.org
- « Alkuperä, ominaisuudet, osat, toiminnot, tyypit, tyypit
- 80 syytä miksi rakastan sinua tai rakastan »

