Pi -linkki
- 4857
- 1448
- Alonzo Kirlin
Selitämme, mikä PI -linkki on, miten sen ominaisuudet muodostuvat, ja annamme useita esimerkkejä
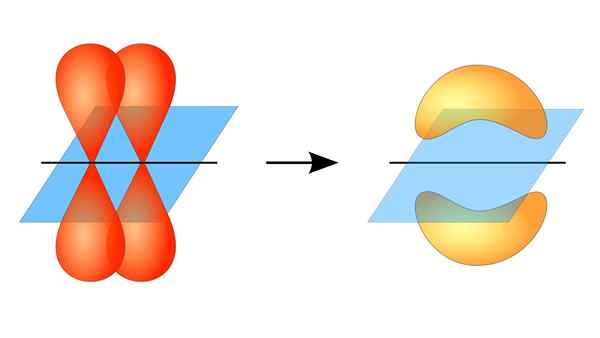
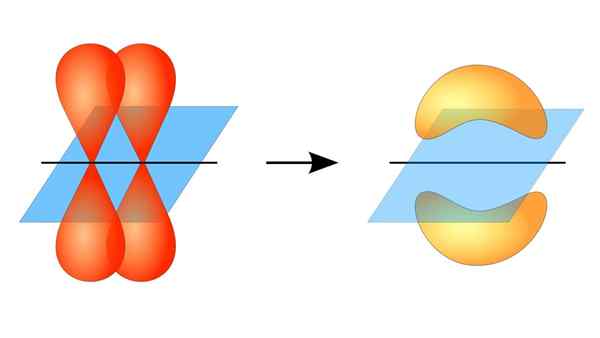 Kaksi orbitaalia p muodostaa linkin π
Kaksi orbitaalia p muodostaa linkin π Mikä on pi -linkki?
Eräs Pi -linkki (π) Se on kovalenttinen linkkityyppi, jolle on tunnusomaista, estämällä atomien vapaan kiertoliike ja peräisin puhtaiden atomien kiertoratojen välillä muun muassa erityispiirteitä. On linkkejä, jotka voidaan muodostaa atomien välillä niiden elektronien avulla, joiden avulla ne voivat rakentaa suurempia ja monimutkaisempia rakenteita: molekyylit.
Nämä yhteydet voivat olla erilaisia lajikkeita, mutta yleisimmät tällä tutkimuksen alalla ovat kovalenttinen. Kovalenttiset sidokset, joita kutsutaan myös molekyyliksi, ovat tyyppinen linkki, jossa mukana olevat atomit jakavat elektroniparit.
Tämä voi tapahtua atomien tarvetta etsiä stabiilisuutta, mikä muodostaa suurimman osan tunnetuista yhdisteistä. Tässä mielessä kovalenttiset sidokset voivat olla yksinkertaisia, kaksinkertaisia tai kolminkertaisia, niiden kiertoratojen kokoonpanosta riippuen ja mukana olevien atomien välillä jaettujen elektroniparien määrä.
Tästä syystä on kahden tyyppisiä kovalenttisia sidoksia, jotka muodostetaan atomien välillä niiden orbitaalien suuntauksen perusteella: sigma (σ) linkit ja PI (π) -linkit (π).
On tärkeää erottaa molemmat linkit, koska sigma -linkki on esitetty yksinkertaisilla ammattiliitoilla ja PI useissa ammattiliitoissa atomien välillä (kaksi tai useampia elektronia jaetaan).
Kuinka pi -linkki on muodossa?
PI -linkin muodostumisen kuvaamiseksi siitä tulisi ensin keskustella hybridisaatioprosessista, koska se puuttuu joihinkin tärkeisiin linkkeihin.
Hybridisaatio on prosessi, jossa hybridielektroniset kiertoradat muodostetaan; eli missä atomi -ala -tason orbitaalit S ja P voidaan sekoittaa. Tämä aiheuttaa SP: n, SP -orbitaalien muodostumisen2 ja SP3, joita kutsutaan hybrideiksi.
Voi palvella sinua: palautuva reaktio: Ominaisuudet ja esimerkitTässä mielessä PI -linkkien muodostuminen tapahtuu parin atomi -kiertoradan päällekkäisyyden ansiosta toisessa kiertoradalla sijaitsevassa lohkoparissa, joka on osa toista atomia.
Tämä kiertoradan päällekkäisyys tapahtuu sivusuunnassa, joten elektroninen jakauma on keskittynyt pääosin kytkettyjen atomien ytimien muodostavan tason ylä- ja alapuolelle ja aiheuttaa PI -sidosten olevan heikompia kuin sigma -sidokset.
Kun puhut tämän tyyppisen liiton kiertoradan symmetriasta, on syytä mainita, että se on yhtä suuri kuin tyypin P P -orbitaalien, niin kauan kuin sitä havaitaan linkin muodostaman akselin kautta. Lisäksi nämä ammattiliitot muodostavat enimmäkseen orbitaalit p.
PI -sidosmuodostus eri kemiallisissa lajeissa
Koska PI -sidoksiin liittyy aina yksi tai kaksi muuta linkkiä (yksi sigma tai toinen Pi ja yksi sigma), on tärkeää tietää, että kahden hiiliatomin välillä muodostettu kaksoissidos (muodostettu sigma -sidoksella ja yksi pi) on alhaisempi linkkienergia kuin se, joka vastaa kahdesti Sigma -linkkiä näiden kahden välillä.
Tämä selitetään Sigma -linkin stabiilisuudella, joka on suurempi kuin PI -sidoksen sidoksella, koska jälkimmäisen atomiorbitaalien päällekkäisyys tapahtuu samanaikaisesti lohkojen ylä- ja alla olevilla alueilla, keräämällä elektronista jakautumista kauempana atomitietä varten atomilla ytimet.
Tästä huolimatta, kun PI- ja Sigma -linkit yhdistetään monimuotoisempi linkki kuin yksinkertainen linkki itsessään, joka voidaan varmistaa tarkkailemalla eri atomien välisiä linkkejä yksinkertaisilla ja useilla linkillä.
Voi palvella sinua: ei -metalliset oksiditJotkut kemialliset lajit, joita tutkitaan niiden poikkeuksellisen käyttäytymisen perusteella, kuten koordinointiyhdisteet metallielementtien kanssa, joissa keskustomeja yhdistyvät vain PI -sidoksilla.
Pi -linkin ominaisuudet
Ei salli atomien vapaata kiertoliikettä
Jäljempänä kuvataan ominaisuudet, jotka erottavat PI -yhteydet muun tyyppisistä atomilajien välisistä vuorovaikutuksista, alkaen siitä, että tämä liitto ei salli atomien vapaata kiertoliikettä, kuten hiili. Tästä syystä, jos atomien kiertäminen tapahtuu, sidoksen repeämä tapahtuu.
Orbitaalien välinen päällekkäisyys kahdella rinnakkaisalueella
Samoin näissä yhteyksissä kiertoratojen välillä tapahtuu päällekkäisyys kahden rinnakkaisen alueen kautta, mikä tekee niistä suuremman diffuusion kuin sigma -sidokset ja että tästä syystä ne ovat heikompia.
Muutaman puhtaan atomin orbitaalin välillä
Toisaalta, kuten edellä mainittiin, PI -linkki syntyy aina puhtaan atomien kiertoradan parissa; Tämä tarkoittaa, että syntyy kiertoratoja, jotka eivät ole kärsineet hybridisaatioprosesseja, joissa elektronien tiheys on enimmäkseen keskittynyt Covalent Unionin muodostaman tason ylä- ja alapuolelle.
Tässä mielessä useampi kuin yksi PI -linkki voidaan esitellä parin atomin joukossa, joihin liittyy aina Sigma -linkki (kaksoissidoksissa).

Samoin voit antaa kolminkertaisen yhteyden kahden vierekkäisen atomin välillä, jotka muodostuvat kahdella PI -sidoksella asennoissa, jotka muodostavat kohtisuorat tasot toistensa kanssa, ja sigma -yhteyden kahden atomin välillä.
Voi palvella sinua: humiinihappo: rakenne, ominaisuudet, hankkiminen, käyttöEsimerkkejä pi -linkeistä
Etyleenimolekyyli
Kuten aiemmin todettiin, yhtenä tai useamman PI -sidoksen yhdistyneiden atomien muodostamilla molekyyleillä on aina useita linkkejä; eli kaksinkertainen tai kolminkertainen.
Esimerkki tästä on eteenimolekyyli (H2C = ch2), joka muodostaa kaksinkertainen liitto; Toisin sanoen PI ja yksi sigma -sidos hiiliatomien välillä, hiilihiilien ja hydrogenssien välisten sigma -sidosten lisäksi.
Asetyleenimolekyyli
Asetyleenimolekyylillä (H-C≡C-H) puolestaan on kolminkertainen yhteys hiiliatomien välillä; toisin sanoen kaksi PI-sidosta, jotka muodostavat kohtisuorat tasot ja sigma-sidos vastaavien hiilivety-sidosten lisäksi.
Bentseeni ja johdannaiset
Pi -sidokset syklisten molekyylien välillä on myös esitetty, kuten bentseeni (C6H6) ja sen johdannaiset, joiden sijoitus johtaa resonanssiin kutsuttuun vaikutukseen, joka sallii elektronisen tiheyden siirtymisen atomien välillä ja apurahaa muun muassa suuremman stabiilisuuden yhdisteelle.
Dikarboni
Aikaisemmin mainituista poikkeuksista esimerkittämiseksi dikarbonalimolekyylin tapaukset (c = c, jossa molemmissa atomeissa on pari parillisia elektroneja) ja Heksacarbonildihierro -niminen koordinointiyhdiste (edustettuna uskoksi2(CO)6, jonka muodostavat vain PI -yhteydet sen atomien joukossa).

