Entalpía
- 2463
- 372
- Gustavo Runte DVM
Mikä on entalpia?
Se entalpía Se on termodynaaminen ominaisuus, jonka vaihtelu vakiona lämpötila- ja paine -olosuhteissa määrittää kemialliseen reaktioon tai fysikaaliseen prosessiin liittyvän aineen tai järjestelmän kalorienergian. Koska se on valtion funktio, se on edustettuna pääomassa H -kirjaimella, se on ΔH sen variaatio.
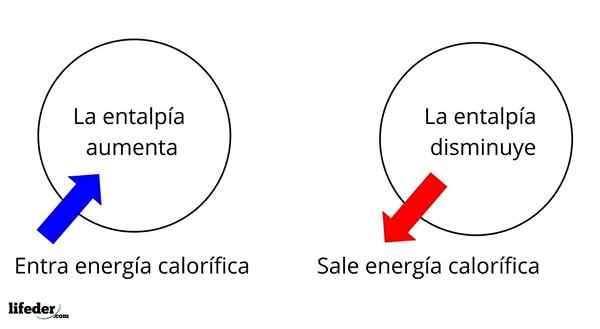
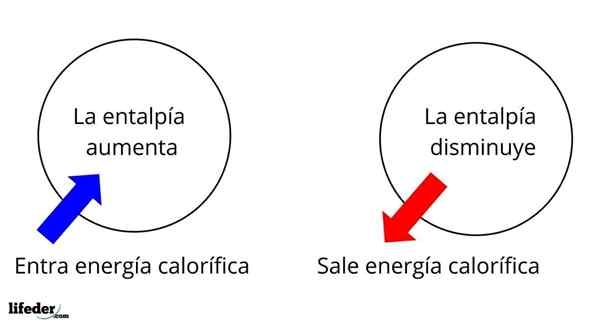
Se on yksi laajimmista laajimmista ominaisuuksista tutkia monien reaktioiden lämpökemiaa; Eli puhumme lämmön irrottautumisesta tai imeytymisestä reaktion väliaineen ja sen ympäristön välillä. Siten sanomme, että reaktio on eksoterminen, jos sen ΔH on negatiivinen (ΔH 0).
 Entalpian muutos jään sulamisessa on positiivinen, mikä osoittaa, että jää imee lämpöä ympäristöstä siirtyäkseen nestetilaan, veteen
Entalpian muutos jään sulamisessa on positiivinen, mikä osoittaa, että jää imee lämpöä ympäristöstä siirtyäkseen nestetilaan, veteen Esimerkiksi jäällä on entalpia, hjäätyä, Vaikka vedellä on myös oma entalpia, hvettä. Kun jää sulaa, tapahtuu entalpian variaatio, nimeltään ΔHFus tai sulaa lämpöä (Hvettä-Hjäätyä-A. Vesien entalpia on parempi kuin jää, aiheuttaen ΔHFus Jää on positiivinen ja sillä on +6 -arvo.01 kJ/mol.
Entalpia ja sen variaatio ilmaistaan yleensä Joule- tai kaloreita. Entalpian muutos +6.01 kJ/mol osoittaa, että jäämolin on absorboida 6.01 kJ kalorienergiaa tai lämpöä sulaa.
Kuinka entalpia lasketaan?
Entalpia ja sen variaatio
Itse entalpia on lukemattomia, koska se riippuu muuttujista, joita on vaikea mitata tarkalleen. Hyvä vertailu olisi haluta mitata valtamerten kokonaistilavuus: Maan alla on aina osia tai hajallaan mantereiden keskuudessa. Siksi ja käytännössä h ei voida määrittää; Mutta kyllä ΔH.
Voi palvella sinua: kolloidiMatemaattisen lausekkeen saavuttamiseksi, joka sallii ΔH: n laskennan, se on ensin jäljellä entalpian perusmääritelmästä:
H = u + pv
Koska kyseinen järjestelmä on kyseisen järjestelmän tai kyseisen aineen sisäinen energia, ja PV Paine-tilavuustyötä, jota tämä järjestelmä käyttää ympäristössä, olemassaoloon. Koska olemme kiinnostuneita laskemasta ΔH ja ei h, meillä on:
ΔH = ΔU + Δ (PV)
Jos paine on vakio, yhtälö säilyy:
ΔH = ΔU + PδV
Tiedämme toisaalta, että:
ΔU = Q - + W -
Olemus Q - Lämpö ja w työ. Korvaa meidät:
ΔH = Q - + W + PδV
Mutta lisäksi tiedämme sen:
W = - pδv
Ja siksi:
ΔH = Q - - Pδv + pδV
ΔH = Q -
Toisin sanoen ΔH reaktiota tai prosessia varten, joka suoritetaan vakiopaineessa, on yhtä suuri kuin lämpö Q - syntynyt tai imeytynyt.
Reaktiot entalpian muutokset
Oletus siitä, että paine pysyy vakiona, on mahdollista, jos reaktio tapahtuu maan ilmakehän alla. Esimerkiksi talvimaisemien jää sulaa ilman toista painetta kuin ilmakehän. Toisaalta se koskee myös reaktioita nestemäisissä väliaineissa tai sellaisia, jotka eivät tuota suuria määriä kaasuja.
Nämä reaktiot imevät tai vapauttavat lämpöä Q - yhtä suuri kuin ΔH, joka puolestaan on entalpilaisten ero tuotteiden ja reagenssien välillä:
ΔH = HTuotteet - HReagenssit
Entalpiatyypit
On yleinen käytäntö puhua ΔH: sta ja H: sta ikään kuin ne olisivat samat: molempia kutsutaan entalpiksi. Tyyppien suhteen H on kuitenkin ainutlaatuinen jokaiselle aineelle tai järjestelmälle; Toisaalta ΔH on itsessään reaktion tai prosessin luonne.
Tässä mielessä meillä on ensin positiivisia entalpian variaatioita (ΔH> 0) tai negatiivisia (ΔH <0); unas corresponden a los procesos o reacciones endotérmicos (se enfrían los alrededores), mientras las segundas tienen que ver con los procesos o reacciones exotérmicos (se calientan los alrededores).
Se voi palvella sinua: nitrobentseeni (C6H5N2): rakenne, ominaisuudet, käyttö, riskitMerkki '+' tai '-', joka liittyy ΔH: iin, kertoo meille siis, jos lämmön vapautuminen tai imeytyminen tietyssä reaktiossa tai prosessissa; joilla on ΔH -ominaisuutensa osana niiden lämpökemiallisia ominaisuuksia.
Meillä on tyyppisiä entalpiatyyppejä, jotka voidaan luokitella fysikaalisten prosessien tai kemiallisten reaktioiden mukaan.
Fyysiset prosessit
Vaihemuutos entalpia
Aineiden on absorboitava tai vapautettava lämpöä siirtyäkseen materiaali- tai materiaalifaasista (kiinteä, neste tai kaasu) toiseen. Esimerkiksi jää absorboi lämpöä sulamaan, joten entalpia tähän vaihemuutokseen vastaa fuusiota, ΔHFus, kutsutaan myös piileväksi lämmöksi.
Liukenemisen tai seoksen entalpia
Aineet liuenneen tai sekoitettuna liuotinväliaineeseen voivat absorboida tai vapauttaa lämpöä, siten entalpia ΔHDis tai ΔHSekoittaa.
Kemialliset reaktiot
Koulutus-
Se on siihen liittyvä lämpö, ΔHºF, yhdisteen muodostumiseen, erityisesti yhden moolin, sen ainesosista tavanomaisissa paineen ja lämpötilan olosuhteissa (t = 298.15 K ja P = 1 atm).
Hajoamis entalpia
Se on liittyvä lämpö, ΔHdes, yhdisteen hajoamiseen pienemmissä ja yksinkertaisissa aineissa. Se on yleensä positiivinen, koska lämpöä tarvitaan molekyylien sidosten rikkomiseksi.
Hydraus entalpia
Se on liittyvä lämpö, ΔHh, Vetymolekyylin riippuvuuteen yhdisteeseen, yleensä hiilivety.
Palamisen entalpia
Se on vapautuva lämpö, ΔHkampa, Kun aine polttaa reagoivan hapen kanssa. Se on negatiivinen, koska lämpö ja valo vapautuvat (tuli).
Se voi palvella sinua: Atomi -massa: Määritelmä, tyypit, kuinka laskea, esimerkkejäEsimerkkejä entalpiesista
Lopuksi mainitaan joitain erityisiä esimerkkejä entalpiaista:
Metaanipalkka
CH4 + 22 → CO2 + 2H2JOMPIKUMPI
ΔH = -890.3 kJ/mol
Toisin sanoen yksi Cho -mooli4 Kun palaminen vapauttaa 890.3 kJ kalorienergiaa.
Etyleenin hydraus
CH2= Ch2 + H2 → ch3CH3
ΔH = -136 kJ/mol
Eteenin mooli vapauttaa 136 kJ lämpöä, kun vety tulee etaaniksi.
Suolata veteen
Pöytäsuola, NaCl, liukenee veteen NA -ionien erottamiseksi+ ja cl- Kiteisten verkkojen ja vesimolekyylien surround (hydraatti):
NaCl (s) → NA+(AC) + CL-(AC)
ΔH = +3.87 kJ/mol
Toisin sanoen suolan liukeneminen veteen, lasin tai astian jäähdyttämiseksi. Absorboitunut määrä lämpöä on kuitenkin hyvin pieni, joten kätemme tuntevat vain pienen lämpötilan muutoksen.
Kaliumkloraatti liukeneminen vedessä
Toisaalta kaliumkloraatti, kclo3, Siinä on ΔHDis Erittäin positiivinen:
Kcl3(s) → K+(AC) + CLO3-(AC)
ΔH = +41.38 kJ/mol
Mikä tarkoittaa, että liukenemiseksi veteen se imee erittäin kuumana. Ja siksi säiliö jäähtyy merkittävästi, ja näemme, että ympäröivä vesihöyry kostuttaa sen ulkopinnan.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Wikipedia. (2020). Entalpia. Haettu: vuonna.Wikipedia.org
- Helmestine, Anne Marie, PH.D -d. (28. elokuuta 2020). Kemian ja fysiikan entalpian määritelmä. Toipunut: Admingco.com
- Andrew Rader Studios. (2015). Energia- ja entalpia. Toipunut: Physics4kids.com
- Kiduttaa. (2020). Entalpia tosiasiat lapsille. Haettu: tosiasiat.Kiduttaa.yhteistyö
- Hallinto. (21. joulukuuta 2010). Entalpia. Talteenotettu: oksiorgaaninen kemikaali.com
- María Estela Raffino. (11. heinäkuuta 2020). Entalpia -konsepti. Toipunut: Konsepti.-

