Ominaispiirteiden kvaternäärinen rakenne

- 3492
- 107
- Eddie Hackett
Se Kvaternäärinen rakenne proteiineja määrittelee alueelliset suhteet sen kunkin sen polypeptidien alayksiköiden välillä. Polymeerisissä proteiineissa kutakin polypeptidiketjusta, jotka tekevät sen, kutsutaan alayksiköiksi tai protomeeriksi.
Proteiinit voivat muodostaa yhden (monomeerinen), kahdella (dimérica), useilla (oligomeerisilla) tai monilla protomeereillä (polymeerinen). Näillä protomeereillä voi olla samanlainen tai hyvin erilainen molekyylirakenne niiden välillä. Ensimmäisessä tapauksessa sanotaan, että ne ovat homotyyppisiä proteiineja ja toisessa tapauksessa heterotyyppinen.
 Esimerkki proliferaatiosolujen ydinantigeeniproteiinin kvaternäärisestä rakenteesta. Otettu ja muokattu osoitteesta: Thomas Shafee [CC 4: llä.0 (https: // creativecommons.Org/lisenssit/by/4.0)].
Esimerkki proliferaatiosolujen ydinantigeeniproteiinin kvaternäärisestä rakenteesta. Otettu ja muokattu osoitteesta: Thomas Shafee [CC 4: llä.0 (https: // creativecommons.Org/lisenssit/by/4.0)]. Tieteellisessä merkinnässä biokemistit käyttävät kreikkalaisia kirjaimia alaindekseillä kuvaamaan proteiinien protomeerien koostumusta. Esimerkiksi tetrameerinen homotyyppinen proteiini on nimetty a: ksi4, Kun taas kaksi eri dimeeriä muodostama tetrameerinen proteiini on nimetty a: ksi2β2.
[TOC]
Proteiinirakenne
Proteiinit ovat monimutkaisia molekyylejä, jotka saavat erilaisia kolmen dimensioisia kokoonpanoja. Nämä kokoonpanot ovat yksinoikeudella jokaiselle proteiinille ja antavat niiden suorittaa hyvin erityisiä toimintoja. Proteiinien rakenteellisen organisaation tasot ovat seuraavat.
Ensisijainen rakenne
Se viittaa sekvenssiin, jossa polypeptidiketjun eri aminohapot on järjestetty. Tämä sekvenssi annetaan DNA -sekvenssillä, joka koodaa tällaista proteiinia.
Toissijainen rakenne
Suurin osa proteiineista ei ole pitkiä täysin laajennettuja aminohappoja, mutta niissä on alueita, jotka on taitettu säännöllisesti potkurien tai arkkien muodossa. Tätä taittoa kutsutaan toissijaiseksi rakenteeksi.
Korkea -asteen rakenne
Toissijaisen rakenteen taitetut alueet voivat puolestaan taittaa ja koota kompakteihin rakenteisiin. Tämä viimeinen taito on se, joka antaa proteiinille kolmen dimensionaalisen muodon.
Kvaternäärinen rakenne
Proteiineissa, jotka muodostuvat useammalla kuin yhdellä alayksiköllä, kvaternääriset rakenteet ovat kunkin alayksikön välisiä alueellisia suhteita, jotka yhdistetään ei -kovalenttisilla sidoksilla.
Voi palvella sinua: kuinka sienet hengittävät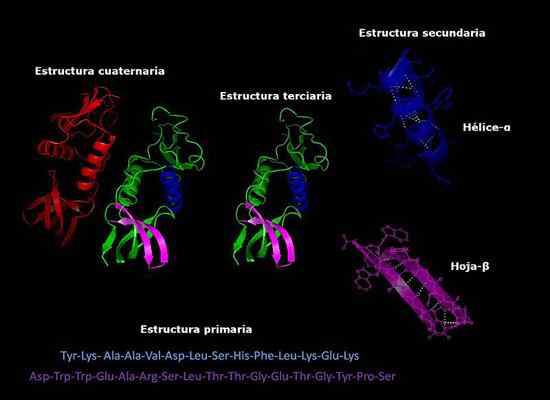 Proteiinien primaariset, sekundaariset, tertiääriset ja kvaternääriset rakenteet, kolmen dimensioinen konformaatio. Otettu ja muokattu osoitteesta: Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)].
Proteiinien primaariset, sekundaariset, tertiääriset ja kvaternääriset rakenteet, kolmen dimensioinen konformaatio. Otettu ja muokattu osoitteesta: Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Kvaternäärisen rakenteen vakaus
Proteiinien kolmiulotteinen rakenne stabiloituu heikkolla tai ei -kovalenttisella vuorovaikutuksella. Vaikka nämä linkit tai vuorovaikutukset ovat paljon heikompia kuin normaalit kovalenttiset sidokset, nämä ovat lukuisia ja niiden kumulatiivinen vaikutus on voimakas. Seuraavaksi näemme joitain yleisimmistä vuorovaikutuksista.
Hydrofobiset vuorovaikutukset
Jotkut aminohapot sisältävät hydrofobisia sivuketjuja. Kun proteiineja on nämä aminohapot, molekyylin taittaminen tilataan nämä sivuketjut proteiiniin ja suojaa niitä vedeltä. Eri sivuketjujen luonne aiheuttaa niiden edistämisen eri tavoin hydrofobisessa vaikutuksessa.
Van der Waals -vuorovaikutukset
Nämä vuorovaikutukset tapahtuvat, kun molekyylit tai atomit, joita kovalenttiset sidokset eivät yhdistä.
Tuolloin näiden atomien välille vahvistetaan torjuntavoima, joka kasvaa erittäin nopeasti heidän vastaavien keskuksensa likimääräisinä. Nämä ovat niin kutsuttuja van der waals "voimia".
Kuormitusvuorovaikutukset
Muutaman ladatun hiukkasen välillä tapahtuu sähköstaattinen vuorovaikutus. Proteiineissa tällaisia vuorovaikutuksia tapahtuu sekä proteiinin nettovarauksen että sisäpuolella olevien ionien yksittäisen kuormituksen vuoksi. Tämän tyyppisiä vuorovaikutuksia kutsutaan joskus Puente Salinoksi.
Vety sidokset
Kiinnitetyn vetyatomin väliin muodostetaan vety sidos.
Tämäntyyppinen sidos on erittäin tärkeä, koska monien molekyylien, mukaan lukien veden ja biologisten molekyylien, ominaisuudet johtuvat suurelta osin vety sidoksista. Jaa kovalenttisten sidosten ominaisuudet (elektronit ovat jaettuja) ja myös ei-kovalenttisia vuorovaikutuksia (lastin vuorovaikutus).
Voi palvella sinua: ohimenevät viljelykasvitDipolos -vuorovaikutus
Molekyyleissä, mukaan lukien proteiinit, joilla ei ole nettokuormaa, niiden sisäisten kuormitusten epäyhtenäinen sijoittaminen voidaan lähettää, hieman negatiivisemmalla päällä kuin toinen. Tätä kutsutaan dipoliksi.
Tämä molekyylin dipoli -tila voi olla pysyvä, mutta se voidaan myös indusoida. Dipolot voidaan houkutella ioneihin tai muihin dipoleihin. Jos dipolit ovat pysyviä, vuorovaikutuksessa on suurempi laajuus kuin esitetään indusoiduilla dipoleilla.
Näiden ei -kovalenttisten vuorovaikutusten lisäksi jotkut oligomeeriset proteiinit stabiloivat kvaternäärirakenteensa kovalenttisen linkkityypin avulla, disulfidilinkki. Ne on määritetty eri protomeerien kysteonien sulfhydrillo -ryhmien välillä.
Disulfuro -sidokset auttavat myös stabiloimaan proteiinien sekundaarista rakennetta, mutta tässä tapauksessa kysteiinijätteet yhdistyvät samaan polypeptidiin (intrapopolipeptididisulfidilinkit).
Protomerien välinen vuorovaikutus
Kuten aiemmin todettiin, proteiineissa, jotka koostuvat useista alayksiköistä tai protomeereistä, nämä alayksiköt voivat olla samanlaisia (homotyyppisiä) tai erilaisia (heterotyyppisiä).
Homotyyppinen vuorovaikutus
Proteiinin muodostavat alayksiköt ovat epäsymmetrisiä polypeptidiketjuja. Homotyyppisissä vuorovaikutuksissa näihin alayksiköihin voidaan kuitenkin liittyä eri tavoin erityyppisiä symmetriaa.
Ryhmät, jotka ovat vuorovaikutuksessa kunkin protomeerin kanssa. Erilaisten alayksiköiden väliset heterologiset vuorovaikutukset tapahtuvat joskus siten, että kukin alayksikkö on vinossa ennakkotapauksen suhteen, kierteinen rakenne ja kierteinen rakenne voidaan saavuttaa.
Muissa tapauksissa vuorovaikutukset annetaan siten, että määriteltyjen alayksiköiden ryhmät on järjestetty yhden tai useamman symmetria -akselin ympärille, ns. Point -ryhmän symmetria. Kun symmetria -akseleita on useita, jokainen alayksikkö on rikki suhteessa 360 °/N -naapuriin (missä n edustaa akselien lukumäärää).
Se voi palvella sinua: Australian kasvisto ja eläimistö: edustavat lajitTällä tavoin saatujen symmetrian tyyppeistä ovat esimerkiksi kierteiset, kuutio ja ikosaedr.
Kun kaksi alayksikköä on vuorovaikutuksessa binaarisen akselin läpi, jokainen yksikkö rikkoutui 180 ° toiseen, kyseisen akselin ympärille. Tämä symmetria tunnetaan nimellä symmetria c2. Siinä kunkin alayksikön vuorovaikutuspaikat ovat identtisiä; Tässä tapauksessa heterologien vuorovaikutuksesta ei ole puhetta, vaan isologisesta vuorovaikutuksesta.
Jos päinvastoin, dimeerin kahden komponentin välinen yhteys on heterologi, saadaan epäsymmetrinen dimeeri.
Heterotyyppinen vuorovaikutus
Ei aina proteiinissa vuorovaikutteiset alayksiköt ovat samanlaisia. On proteiineja, jotka muodostuvat kahdellatoista tai enemmän eri alayksiköitä.
Proteiinin stabiilisuuden ylläpitävät vuorovaikutukset ovat samat kuin homotyyppisissä vuorovaikutuksissa, mutta täysin epäsymmetriset molekyylit saadaan yleensä.
Esimerkiksi hemoglobiini on testaaja, joka esittelee kaksi paria eri alayksiköitä (a2β2-A.
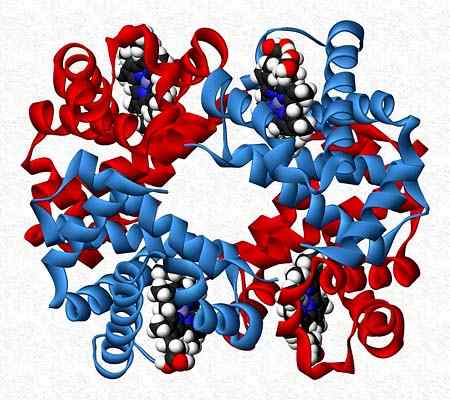 Hemoglobiinin kvaternäärinen rakenne. Otettu ja muokattu osoitteesta: Benjah-BMM27. Muokattu Alejandro Porto. [CC0].
Hemoglobiinin kvaternäärinen rakenne. Otettu ja muokattu osoitteesta: Benjah-BMM27. Muokattu Alejandro Porto. [CC0]. Viitteet
- C.K -k -. Mathews, k.JA. Pakettiauto Hold & k.G. Ahern (2002). Biokemia. 3. painos. Benjamin / Cummings Publishing Company, Inc.
- R -.K -k -. Murray, P. Mayes, D.C. Granner & V.W -. Rodwell (1996). Harperin biokemia. Appleton & Lange
- J -.M. Berg, J.Lens. Tymoczko & l. Stryer (2002). Biokemia. 5. painos. W -. H. Freeman ja yritys.
- J -. Koolman & K.-H. Roehm (2005). Biokemian väri. 2. painos. Thieme.
- -Lla. Lehninger (1978). Biokemia. Omega Editions, S.-Lla.
- Lens. Stryer (1995). Biokemia. W -.H. Freeman and Company, New York.
- « 1800 -luvulla chilen väestössä, yhteiskunnassa, taloudessa ja politiikassa
- Vimentinin ominaisuudet, rakenne, toiminnot ja käyttötarkoitukset »

