Pääominaisuuksien tertiäärinen rakenne
- 647
- 162
- Joshua Emmerich
Se Proteiinien tertiäärinen rakenne Polypeptidiketjut hankkivat kolmen dimensionaalisen konformaation taittaessa itseään. Tämä konformaatio ilmenee vuorovaikutuksista polypeptidin aminohappojätteiden sivuketjujen välillä. Sivuketjut voivat olla vuorovaikutuksessa riippumatta niiden asemasta proteiinissa.
Koska se riippuu R -ryhmien välisistä vuorovaikutuksista, tertiäärinen rakenne osoittaa ketjun ei -toistuvia näkökohtia, koska nämä ryhmät ovat erilaisia jokaiselle aminohappotähteelle. Toissijainen rakenne puolestaan riippuu karboksyyli- ja aminohuryhmistä, joita on kaikissa aminohapoissa.
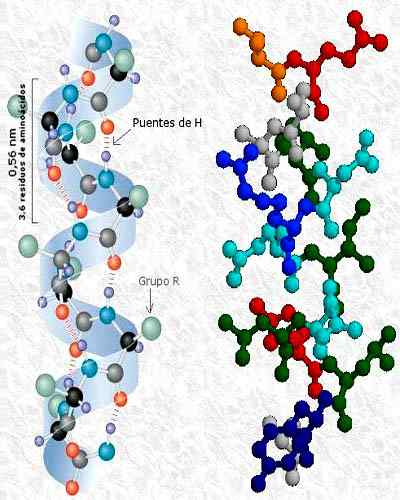
 Kinaasifosfataasiproteiinin tertiäärinen rakenne, jossa on sekundaariset rakenteet alfa- ja beetalehdessä. Otettu ja muokattu osoitteesta: A2-33. Muokattu Alejandro Porto. [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)].
Kinaasifosfataasiproteiinin tertiäärinen rakenne, jossa on sekundaariset rakenteet alfa- ja beetalehdessä. Otettu ja muokattu osoitteesta: A2-33. Muokattu Alejandro Porto. [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)].
Jotkut kirjoittajat ehdottavat, että kuitumaisilla proteiineilla on yksinkertainen tertiäärinen rakenne, mutta silti toiset kirjoittajat huomauttavat, että tämä rakenne on tyypillinen globaaleille proteiineille.
[TOC]
Kuituproteiinit
Kuituproteiineissa polypeptidiketjut on järjestetty pitkien filamenttien tai pitkien arkkien muodossa; Ne koostuvat yleensä ainutlaatuisesta toissijaisesta rakenteesta. Tämä toissijainen rakenne on useimmissa tapauksissa tärkeämpi kuin tertiäärinen rakenne proteiinin muodon määrittämisessä.
Sen biologinen toiminta on rakenteellista, myöntävää lujuutta ja/tai joustavuutta elimille ja rakenteille, joissa niitä löytyy, pitäen ne yhdessä yhdessä. Kaikki kuitumaiset proteiinit ovat liukenemattomia veteen johtuen suuresta määrästä heidän läsnä olevia hydrofobisia aminohappoja.
Näiden kuituproteiinien joukossa ovat keratiineja ja kollageenia. Entisiä löytyy konjunktiivisista kankaista ja rakenteista, kuten karvoista, kynsistä (a-queratinas), asteikoista ja höyhenistä (β-cheatiinit). Sillä välin kollageeni löytyy luista, jänteistä ja ihosta muun muassa.
α-queratinas
Nämä proteiinit ovat osa SO: n nostettuja välituotteiden proteiineja, joilla on tärkeä rooli monisoluisten organismien sytoskeletonissa. Lisäksi ne ovat karvojen, kynsien, villan, sarvien, sorkkien ja yhden tärkeimpien eläinten ihoproteiinien tärkein aineosa.
Voi palvella sinua: Kinyounin värjäysMolekyylin rakenne on a -potkuri. Kaksi α-queratiinin säikettä voidaan järjestää rinnakkain ja ilmoittautua toiseen niiden R-hydrofobisten ryhmien kanssa, jotka ovat vuorovaikutuksessa niiden välillä. Tällä tavalla superhelinen tai pallorakenne luodaan vasemmalle käämityksellä.
A-keratiinin tertiäärinen rakenne on yksinkertainen ja hallitsee a-helixin sekundaarinen rakenne. Toisaalta myös kvaternäärinen rakenne on läsnä, koska kaksi molekyyliä osallistuu superhelikoidiseen rakenteeseen, joka on vuorovaikutuksessa ei -kovalenttisten sidosten kautta.
β-queratinas
Ensisijainen rakenne on samanlainen kuin a-queratinas, mutta sen sekundaarista rakennetta hallitsevat p-levyt. Ne ovat matelijoiden ja lintujen höyhenten asteikkojen tärkein aineosa.
Kollageeni
Tämä proteiini voi edustaa yli 30% joidenkin eläinten kokonaisproteiinimassasta. Sitä löytyy rustoista, luista, jänteistä, sarveiskalvosta ja ihosta muun muassa.
Kollageenin toissijainen rakenne on ainutlaatuinen, ja sitä edustaa Levogira -potkuri, jolla on 3,3 aminohappojätettä jokaiselle kierrokselle. Kolme levogyaus -potkuriketjua (α).
Tropokollageenimolekyylit kokoontuvat yhteen muodostaen kollageenikuitua, jolla on suuri vastus, korkeampi kuin teräs ja vertailukelpoinen korkean kestävyyden kupariin.
Muut kuituproteiinit
Muun tyyppiset kuituproteiinit ovat fibroiini ja elastiini. Ensimmäisen niistä muodostetaan β -arkit, pääasiassa Glycina, Alanine ja Seriini.
Näiden aminohappojen sivuketjut ovat pieniä, joten ne voidaan pakata tiiviisti. Tuloksena on kuitu, joka on sekä erittäin resistentti että erittäin virrattomat.
Voi palvella sinua: fosfaattipuskuri (PBS): perusta, valmistelu ja käyttöSillä välin elastiinissa Valine korvaa seriinin tärkeimpien ainesosien aminohappojen joukossa. Toisin kuin fibroiini, elastiini on erittäin laajennettavissa, joten sen nimi. Molekyylin perustuslaissa myös lysiini, joka voi osallistua risti -linkkiin, jotka antavat elastiinin palauttaa muodonsa, kun jännitys lakkaa.
Globaali proteiinit
Globaariset proteiinit, toisin kuin kuitumaiset, ovat liukoisia ja niissä on yleensä monen tyyppisiä sekundaarisia rakenteita. Näissä ovat kuitenkin tärkeämpiä kolmen dimensionaalisia konformaatioita, jotka he hankkivat taittaessaan itseään (tertiäärinen rakenne).
Nämä erityiset kolme dimensionaalista konformaatiota antavat spesifisen biologisen aktiivisuuden jokaiselle proteiinille. Näiden proteiinien päätoiminta on säätely, kuten entsyymissä.
Globaalien proteiinien tertiäärisen rakenteen ominaisuudet
Globaalien proteiinien tertiäärisellä rakenteella on joitain tärkeitä ominaisuuksia:
- Globaali proteiinit ovat kompakteja pakkauksen ansiosta, kun polypeptidiketjun laskoset.
- Polypeptidiketjujen primaarirakenteen kaukainen aminohappojäte on lähellä, ja se kykenee vuorovaikutukseen toistensa kanssa taittumisen takia.
- Suurempiin globaaleihin proteiineihin (yli 200 aminohappoa) voi olla useita kompakteja segmenttejä, jotka ovat riippumattomia niiden välillä ja tietyillä toiminnoilla, ja kutakin näistä segmenteistä kutsutaan domeeniksi. Domeenilla voi olla välillä 50–350 aminohappojätettä.
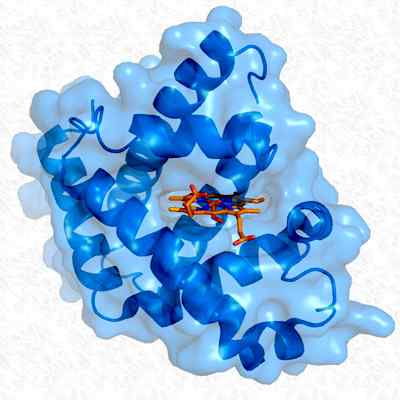 Myoglobiinin tertiäärinen rakenne. Otettu ja muokattu osoitteesta: Thomas Splettstoesser. Muokattu Alejandro Porto. [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)].
Myoglobiinin tertiäärinen rakenne. Otettu ja muokattu osoitteesta: Thomas Splettstoesser. Muokattu Alejandro Porto. [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)].
Yleiset säännöt globaalien proteiinien laskinnasta
Kuten jo todettiin, proteiineilla on erityisiä taittomuotoja, jotka antavat heille myös erityisiä ominaisuuksia. Tämä taittuminen ei ole satunnaista, ja sitä suosii sekä primaarinen että toissijainen rakenne että jotkut ei -kovalenttiset vuorovaikutukset, ja myös taittoa varten on myös joitain fyysisiä rajoituksia, joten joitain sääntöjä on muotoiltu:
Voi palvella sinua: primaariset imusolmukkeet- Kaikissa globaaleissa proteiineissa on määritelty jakautumiskuviot, ja hydrofobiset ryhmät on suunnattu molekyyliin ja hydrofiiliseen jätteeseen ulkokerroksessa ulkokerroksessa. Tätä varten vaaditaan vähintään kaksi kerrosta toissijaista rakennetta. Β-a-β-silmukka ja a-a.
- P -levyt on yleensä järjestetty levogiran valssatussa muodossa.
- Polypeptidiketjussa voi tapahtua erilaisia käännöksiä, jotka siirtyvät sekundaarisesta toiseen rakenteeseen, kuten β- tai y -käännökset, jotka voivat sijoittaa ketjun suunnan neljään aminohappojätteeseen tai vähemmän.
- Globaalissa proteiineissa on a, p -arkit, epäsäännöllisesti jäsenneltyjä käänteitä ja segmenttejä.
Proteiinin denaturointi
Jos proteiini menettää alkuperäisen (luonnollisen) kolmiulotteisen rakenteensa, se menettää biologisen aktiivisuuden ja suurimman osan sen erityisominaisuuksista. Tämä prosessi tunnetaan nimellä denaturoituminen.
Denaturointi voi tapahtua, kun luonnolliset ympäristöolosuhteet muuttuvat, esimerkiksi vaihtelevalla lämpötilan tai pH: n avulla. Prosessi on peruuttamaton monissa proteiineissa; Toiset voivat kuitenkin spontaanisti palauttaa luonnollisen rakenteensa palauttamalla normaalit ympäristöolosuhteet.
Viitteet
- C.K -k -. Mathews, k.JA. Pakettiauto Hold & k.G. Ahern (2002). Biokemia. 3. painos. Benjamin / Cummings Publishing Company, Inc.
- R -.Murray, P. Mayes, D.C. Granner & V.W -. Rodwell (1996). Harperin biokemia. Appleton & Lange.
- J -.M. Berg, J.Lens. Tymoczko & l. Stryer (2002). Biokemia. 5. painos. W -. H. Freeman ja yritys.
- W -.M. Becker, L.J -. Kleinsmith & J. Hardin (2006) solun maailma. 6. painos. Pearson Education Inc.
- -Lla.Lehninger (1978). Biokemia. Omega Editions, S.-Lla.
- T. McKee & J.R -. McKee (2003). Biokemia: elämän molekyylipohja. Kolmas painos. The McGraw-Hiii Companies, Inc.
- « Fermioniset kondensaatin ominaisuudet, sovellukset ja esimerkit
- Dodecil -natriumsulfaatti (SDS) -rakenne, ominaisuudet, käyttää »

