Etano
- 2664
- 203
- Gustavo Runte DVM
 Estano -rakenne
Estano -rakenne Mikä on etaani?
Hän Etano Se on yksinkertainen kaava C hiilivety2H6 Värittömällä ja wc -kaasun luonteella, jolla on erittäin arvokas ja monipuolinen käyttö eteenisynteesissä. Lisäksi se on yksi maakaasuista, jotka on havaittu myös muissa planeetoissa ja tähtirunkoissa aurinkokunnan ympärillä. Tutkija Michael Faraday löysi sen vuonna 1834.
Hiili- ja vetyatomien (tunnetaan nimellä hiilivedyt) muodostaneiden suurten määrien orgaanisten yhdisteiden joukossa on niitä, jotka ovat kaasumaisessa tilassa lämpötiloissa ja ympäristöpaineissa, joita käytetään suuresti lukuisilla toimialoilla.
Ne tulevat yleensä kaasumaisesta seoksesta, jota kutsutaan "maakaasua", ihmiskunnan arvokkaasta tuotteesta ja muodostavat metaanin, etaanin, propaanin ja butaanien tyypit; kelpoisuus sen ketjussa olevien hiiliatomien määrän mukaan.
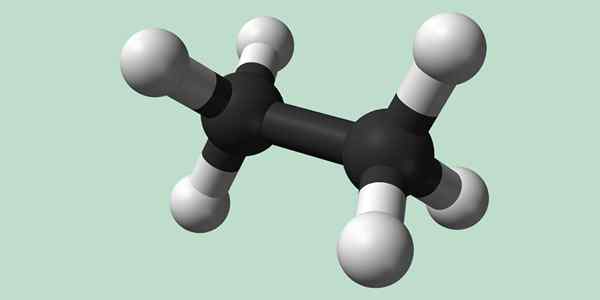
Etaanin kemiallinen rakenne
Estano on kaava C -molekyyli2H6, tyypillisesti kahden metyyliryhmän liitto (-CH3) Yksinkertaisen hiili-hiili-sidoksen hiilivedyn muodostamiseksi. Se on myös yksinkertaisin orgaaninen yhdiste metaanin jälkeen, edustaen itseään:
H3C-C-CH3
Tämän molekyylin hiiliatomilla on SP -tyypin hybridisaatio3, Joten molekyylisidoksilla on vapaa kierto.
Etano on myös luontainen ilmiö, joka perustuu sen molekyylirakenteen pyörimiseen ja vähimmäisenergiaan, joka tarvitaan 360 -asteen linkkien kiertämisen tuottamiseksi, jota tutkijat ovat kutsuneet "etano barrera".
Tästä syystä Ethan.
 Etaanin kemiallinen rakenne. Lähde: Wikimedia Commons
Etaanin kemiallinen rakenne. Lähde: Wikimedia Commons Etaanin synteesi
Estano voidaan helposti syntetisoida Kolbe -elektrolyysistä, orgaanisesta reaktiosta, jossa esiintyy kaksi vaihetta: kahden karboksyylihapon elektrokemiallinen dekarboksylaatio (karboksyyliryhmän poisto ja hiilidioksidin vapauttaminen), ja tuotteiden yhdistelmä on kovalenttinen sidos.
Samoin etikkahappoelektrolyysi johtaa etaanin ja hiilidioksidin muodostumiseen, ja tätä reaktiota käytetään ensimmäisen syntetisoimiseen.
Etikkahappoanhydridin hapettuminen peroksidien vaikutuksella, Kolben elektrolyysi samanlainen käsite johtaa myös etaanin muodostumiseen.
Voi palvella sinua: Kemian panokset ihmisyyteenSamalla tavalla se voidaan erottaa tehokkaasti maakaasusta ja metaanista nesteyttämisprosessilla käyttämällä kryogeenisiä järjestelmiä tämän kaasun kaappaamiseen ja sen erottamiseen seoksista muiden kaasujen kanssa.
Turbo -laajennusprosessi on tämän roolin suosikki: kaasuseos on valmistettu turbiinilla, mikä tuottaa sen laajentumisen, kunnes sen lämpötila laskee alle -100 ° C.
Jo tässä vaiheessa seoksen komponentit voidaan erottaa, joten kaasumaisen metaanin nestemäinen etaani ja muut tislauksen käyttöön liittyvät lajit erotetaan.
Estano -ominaisuudet
Estano esitetään luonteeltaan wc: nä ja väritön kaasu tavanomaiseen paineeseen ja lämpötilaan (1 atm ja 25 ° C). Sen kiehumispiste on -88,5 ° C ja fuusiopiste -182,8 ° C. Lisäksi vahvoille hapoille tai emäksille altistuminen ei vaikuta siihen.
Etaanin liukoisuus
Etano -molekyylit ovat symmetrisiä kokoonpanoja ja niillä on heikko vetovoimat, jotka pitävät niitä yhdessä, kutsutaan dispersiovoimiksi.
Kun etaani yrittää liukentua veteen, kaasun ja nesteen välillä muodostetut vetovoimat ovat erittäin heikkoja, jotta etaani tuskin liittyy vesimolekyyleihin.
Tästä syystä etaanin liukoisuus on huomattavasti alhainen, ja se kasvaa hieman, kun järjestelmäpaine nousee.
Etaanin kiteytys
Estano voidaan kiinteyttää, mikä tekee epävakasta etaanikiteitä kuutiomaisella kiteellä rakenteella.
Kun lämpötila laski yli -183,2 ° C.
Etaanin palaminen
Tätä hiilivetyä, vaikka sitä ei käytetä laajasti polttoaineena, voidaan käyttää polttoprosesseissa hiilidioksidin, veden ja lämmön tuottamiseksi, joka on esitetty seuraavasti:
2 c2H6 + Seitsemäs2 → 4Co2 + 6H2O + 3120 kJ
On myös mahdollisuus polttaa tämä molekyyli ilman ylimääräistä happea, joka tunnetaan "epätäydellisenä palamisna" ja joka johtaa amorfisen hiili- ja hiilimonoksidin muodostumiseen ei -toivotussa reaktiossa, käytetyn hapen määrän mukaan:
Voi palvella sinua: Sterolit: rakenne, toiminnot ja esimerkit2 c2H6 + Kolmas2 → 4C + 6H2Tai + lämpöä
2 c2H6 + Neljäs2 → 2c + 2co + 6h2Tai + lämpöä
2 c2H6 + Viides2 → 4co + 6h2Tai + lämpöä
Tällä alueella palaminen tapahtuu sarjassa vapaiden radikaalien reaktioita, jotka on numeroitu sadoissa erilaisissa reaktioissa. Esimerkiksi epätäydellisissä palamisreaktioissa yhdisteet, kuten formaldehydi, asetaldehydi, metaani, metanoli ja etanoli, voidaan muodostaa.
Tämä riippuu olosuhteista, joissa reaktiot ja reaktiot ovat mukana. Etyleeni voi muodostua myös korkeissa lämpötiloissa (600-900 ° C), mikä on erittäin haluttu tuote teollisuudesta.
Ilmakehässä ja taivaallisissa ruumiissa
Estano on läsnä maapallon ilmakehässä jäljissä, ja epäillään, että ihminen on onnistunut kaksinkertaistamaan tämän keskittymisen, koska hän alkoi harjoittaa teollista toimintaa.
Tutkijoiden mielestä suuri osa ETA: n nykyisestä läsnäolosta ilmakehässä johtuu fossiilisten polttoaineiden palamisesta, vaikka etaanin maailman päästöt ovat vähentyneet melkein puolivälissä siitä, kun Lutita -kaasun tuotantotekniikat paransivat (maakaasulähde).
Tämä laji tapahtuu myös luonnollisesti aurinkosäteiden vaikutuksella ilmakehän metaaniin, joka yhdistää ja muodostaa etaanimolekyylin.
Nestemäisessä tilassa on etaani Titanin pinnalla, yksi Saturnuksen kuusta. Tämä esitetään suuremmalla määrällä Vid Flumina -joella, joka virtaa yli 400 kilometriä yhdelle merelle. Tämä yhdiste on myös todistettu komeetoilla ja Pluto -pinnalla.
Etaanin käyttö
Etyleenin tuotanto
Etaanin käyttö perustuu pääasiassa eteenin tuotantoon, joka on suuremman käytön orgaaninen tuote maailmantuotannossa, prosessin kautta, joka tunnetaan nimellä Steam Stage.
Tämä prosessi koostuu laimennetun etanin läpäisemisestä.
Reaktio tapahtuu erittäin korkeassa lämpötilassa (välillä 850 - 900 ° C), mutta viipymisajan (aika, jonka etaani kulkee uunissa) on oltava lyhyt, jotta reaktio on tehokas. Korkeammissa lämpötiloissa syntyy enemmän etyleeniä.
Voi palvella sinua: Neon: Historia, ominaisuudet, rakenne, riskit, käyttötarkoituksetKemiallinen perusmuodostus
Etanoa on myös tutkittu pääkomponenttina emäksisten kemikaalien muodostumisessa. Oksidatiivinen klooraus on yksi prosesseista, jotka on korotettu vinyylikloridin (PVC -komponentin) saamiseksi, korvaamalla muut taloudelliset ja monimutkaisemmat.
Kylmäaine
Lopuksi, etaania käytetään kylmäaineena tavallisissa kryogeenisissä järjestelmissä, jotka osoittavat myös pienten näytteiden jäätymiskapasiteettia laboratoriossa analysoitavaksi.
Se on erittäin hyvä korvike vedelle, joka vie enemmän herkkien näytteiden jäähdyttämiseen ja voi myös tuottaa haitallisten jääkiteiden muodostumisen.
Etaanin riskit
-Estanolla on kyky tulla tulehtuneiksi, lähinnä kun se liittyy ilmaan. Prosenttiosuus 3,0–12,5%: n määrän etaantilaus ilmassa, räjähtävä seos voidaan muodostaa.
-Se voi rajoittaa happea ilmassa, josta se löytyy, ja tästä syystä se on läsnä ja altistuneiden ihmisten tukehtumisen riskitekijä.
-Jäädytetyn nestemäisen muodon etaani voi polttaa ihon vakavasti, jos se joutuu siihen suoraan kosketukseen, ja toimii myös kryogeenisenä väliaineena kaikille koskettaville esineille, jäädyttämällä se hetkessä.
-Nestemäisen etaanin höyryt ovat ilmaa raskaampia ja keskittyvät maahan, tämä voi aiheuttaa sytytysriskin, joka voi tuottaa ketjun palamisreaktion.
-Etanon nauttiminen voi aiheuttaa pahoinvointia, oksentelua ja sisäisiä verenvuotoja. Hengitys aiheuttaa tukehtumisen lisäksi päänsärkyä, sekaannusta ja huumorimuutosta. Sydänpysähdyksen aiheuttama kuolema on mahdollista korkeissa näyttelyissä.
-Se edustaa kasvihuonekaasua, joka yhdessä metaanin ja hiilidioksidin kanssa myötävaikuttaa ihmisen pilaantumisen aiheuttamaan globaaliin lämmitykseen ja ilmastonmuutokseen. Onneksi se on vähemmän runsas ja kestävä kuin metaani, ja se imee vähemmän säteilyä kuin tämä.
Viitteet
- Britannica, e. (S.F.-A. Etaani. Saatu Britannicalta.com
- Nes, g. V. (S.F.-A. ETAN-, ETHYLEEN- JA ASELINE-ETRONITTIKEUSJAJAUTUMAT. Matto.Nl
- Sivustot, g. (S.F.-A. ETANE: Lähteet ja nieluja. Saatu sivustoilta.Google.com
- Softschools (S.F.-A. Etaan kaava. Talteenotettu softschoolista.com
- Wikipedia (S.F.-A. Etaani. Saatu.Wikipedia.org

