Kalsiumfosfaatti (CA3 (PO4) 2)

- 675
- 52
- Edgar VonRueden
Hän kalsiumfosfaatti Se on epäorgaaninen ja tertiäärinen suola, jonka kemiallinen kaava on CA3(PO4-A2. Kaava osoittaa, että tämän suolan koostumus on vastaavasti kalsiumin ja fosfaatin koostumus. Tämä näkyy suoraan alemmassa kuvassa, missä kationi on esitetty2+ ja anionin po43-. Jokaisesta kolmesta CA: sta2+ PO on kaksi43- vuorovaikutuksessa heidän kanssaan.
Toisaalta kalsiumfosfaatti viittaa sarjaan suoloja, jotka vaihtelevat CA/P -suhteesta riippuen, samoin kuin nesteytyksen ja pH: n asteesta riippuen. Itse asiassa on olemassa monen tyyppisiä kalsiumfosfaatteja, joita on olemassa ja jotka voidaan syntetisoida. Kirjeen jälkeen, nimikkeistö, kalsiumfosfaatti viittaa kuitenkin vain trisikaaliseen, edellä mainittuun.
 Trisikaalisen fosfaatin osuus ja ionit. Lähde: Richard-59 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)], Wikimedia Commons
Trisikaalisen fosfaatin osuus ja ionit. Lähde: Richard-59 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)], Wikimedia Commons Kaikki kalsiumfosfaatit, mukaan lukien CA3(PO4-A2, Ne ovat valkoisia kiinteitä aineita, joissa on pieniä harmaita sävyjä. Ne voivat olla rakeisia, hienoja, kiteisiä ja niiden hiukkaskokoja, jotka ovat mikrometrien ympärillä; Ja jopa näiden fosfaattien nanohiukkaset on valmistettu, joiden kanssa luiden bioyhteensopivat materiaalit on suunniteltu.
Tämä biologinen yhteensopivuus johtuu siitä, että näitä suoloja löytyy hampaista ja lyhyitä kertomuksia nisäkkäiden luukudoksissa. Esimerkiksi hydroksiapatiitti on kiteinen kalsiumfosfaatti, joka puolestaan on vuorovaikutuksessa saman suolan amorfisen faasin kanssa.
Tämä tarkoittaa, että amorfisen ja kiteisen kalsian fosfaatit ovat fosfaatteja. Tästä syystä se ei ole yllättävää monimuotoisuutta ja useita vaihtoehtoja syntetisoidessaan kalsiumfosfaattien perusteella; Materiaalit, joiden ominaisuudet joka päivä ovat kiinnostuneempia tutkijoita ympäri maailmaa keskittyä luun palauttamiseen.
Kalsiumfosfaattirakenne
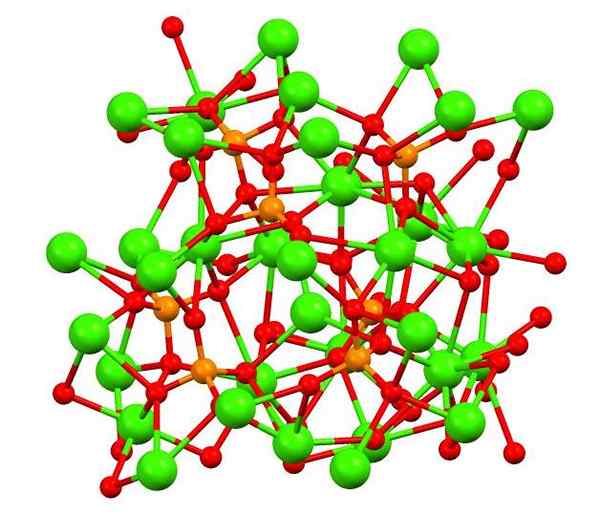 Kalsiumfosfaatti Whitlockita -mineraalissa. Lähde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)], Wikimedia Commons
Kalsiumfosfaatti Whitlockita -mineraalissa. Lähde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)], Wikimedia Commons Yläkuva näyttää tribasic -kalian fosfaatin rakenteen omituisessa Whitlockita -mineraalissa, joka voi sisältää magnesiumia ja rautaa epäpuhtauksina.
Vaikka ensi silmäyksellä se voi vaikuttaa monimutkaiselta, on välttämätöntä selventää, että malli olettaa fosfaattien happiatomien ja kalsiummetallikeskusten happeatomien ja kalsiummetallikeskusten kovalenttisia vuorovaikutuksia.
Voi palvella sinua: beryllium -hydridi (beh2)Esityksenä se on pätevä, vuorovaikutukset ovat kuitenkin sähköstaattisia; eli CA -kationit2+ Tunne vetovoima PO: lle43- (AC2+- O-PO33--A. Tätä silmällä pitäen ymmärretään, miksi kuvan kalsiumissa (vihreät pallot) ympäröivät negatiivisesti varautuneet happiatomit (punaiset pallot).
Kun ioneja on niin paljon, symmetrinen järjestely tai kuvio ei jätä näkyväksi. CA3(PO4-A2 hyväksyy alhaisissa lämpötiloissa (t<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4-A2 (β-TCP, sen lyhenne englanniksi).
Toisaalta korkeissa lämpötiloissa siitä tulee a-CA-polymorfia3(PO4-A2 (α-TCP), jonka yksikkösolu vastaa monokliinistä kiteistä järjestelmää. Vielä korkeammissa lämpötiloissa a'-CA-polymorfia voidaan myös muodostaa3(PO4-A2, joka on kuusikulmainen kiteinen rakenne.
Amorfinen kalsiumfosfaatti
Kiteinen kalsiumfosfaatin rakenteet on mainittu, jota odotetaan suolalta. Tämä pystyy kuitenkin näytölle.
Kun tämä tapahtuu, sanotaan, että kalsiumfosfaatilla on amorfinen rakenne (ACP, Amorfinen kalsiumfosfaatti-A. Useat kirjoittajat viittaavat tämän tyyppiseen rakenteeseen vastuussa CA: n biologisista ominaisuuksista3(PO4-A2 Luukudoksissa korjaus ja biomimeointi on mahdollista.
Muu perhe
Kalsiumfosfaatit ovat itse asiassa epäorgaanisten yhdisteiden perhe, joka puolestaan voi olla vuorovaikutuksessa orgaanisen matriisin kanssa.
Muut fosfaatit saadaan "yksinkertaisesti" muuttamaan kalsiumia seuraavia anioneja (PO43-, HPO42-, H2Poikki4-, vai niin-), kuten kiinteiden epäpuhtauksien tyyppi. Siten enintään yksitoista kalsiumia tai enemmän fosfaatteja, joilla jokaisella on oma rakenne ja ominaisuudet, voi olla peräisin luonnollisesti tai keinotekoisesti.
Jotkut fosfaatit ja niiden vastaavat kemialliset rakenteet ja kaavat mainitaan alla:
-Vety dihydrado kalsiumfosfaatti, cahpo4∙ 2h2O: Monokliininen.
Voi palvella sinua: ammoniumoksalaatti-Dihydrogeenimonohydratoitu kalsiumfosfaatti, CA (H2Poikki4-A2H2O: trikliininen.
-Vedetön dease -fosfaatti, CA (H2Poikki4-A2: Trikliininen.
-Vety oktacalcic fosfaatti (OCP), CA8H2(PO4-A6: Trikliininen. Se on hydroksiapatiitin synteesin edeltäjä.
-Hydroksiapatiitti, ca5(PO4-A3Voi: kuusikulmainen.
Fysikaaliset ja kemialliset ominaisuudet
Nimeä
-Kalsiumfosfaatti
-Trikalsiumfosfaatti
-Trikalidifosfaatti
Molekyylipaino
310,74 g/mol.
Fyysinen kuvaus
Se on valkoinen kiinteä.
Maku
Mauton.
Sulamispiste
1670 ºK (1391 ºC).
Liukoisuus
-Käytännössä liukenematon veteen.
-Liukenematon etanoliin.
-Liukoinen suolahapossa ja laimennettu typpihappo.
Tiheys
3,14 g/cm3.
Taitekerroin
1 629
Vakiokoulutuksen entalpia
4126 kcal/mol.
Säilytyslämpötila
2-8 ºC.
PHE
6-8 vesipitoisessa suspensiossa 50 g/l kalsiumfosfaattia.
Koulutus
Kalsium- ja vetynitraatti -ammoniumfosfaatti
Kalsiumfosfaatin tuottamiseksi tai muodostamiseksi on olemassa lukuisia menetelmiä. Yksi heistä koostuu kahden suolan sekoituksesta, Kalifornia (ei3-A2∙ 4H2Tai, ja (NH4-A2HPO4, aiemmin liuennut absoluuttisessa alkoholissa ja vedessä. Yksi suola lisää kalsiumia ja toinen fosfaatti.
Tästä seoksesta ACP saostuu, joka sitten lämmittää uunissa 800 ° C: ssa ja 2 tunnin ajan. Tämän menettelyn seurauksena saadaan β-CA3(PO4-A2. Lämpötilojen, levottomuuden ja kosketusaikojen huolellisesti kontrolloivat nanokristaalien muodostumista voi tapahtua.
Α-CA-polymorfin muodostamiseksi3(PO4-A2 Fosfaatti on tarpeen lämmittää yli 1000 ° C. Tämä lämpeneminen suoritetaan muiden metalli -ionien läsnä ollessa, jotka stabiloivat tämän polymorfin tarpeeksi, jotta sitä voidaan käyttää huoneenlämpötilassa; eli se pysyy vakaassa kohdetilassa.
Kalsiumhydroksidi ja fosforihappo
Kalsiumfosfaatti voidaan myös muodostaa sekoittamalla kalsiumhydroksidi- ja fosforihappoliuokset, esiintyvät happo-emäs neutralointi. Puolen päivän kypsymisen jälkeen äitien alkoholijuomissa ja niiden asianmukainen suodatus, pesu, kuivaus ja seulottu, amorfisen fosfaatin rakeinen pöly, ACP saadaan.
Tämä korkeiden lämpötilojen ACP -reaktiotuote, joka transformoi seuraavien kemiallisten yhtälöiden mukaan:
2ca9(HPO4) (PO4-A5(OH) => 2ca9(P2JOMPIKUMPI7-A0,5(PO4-A5(Voi) + H2O (a t = 446,60 ° C)
2ca9(P2JOMPIKUMPI7-A0,5(PO4-A5(OH) => 3ca3(PO4-A2 + 0,5h2O (a t = 748,56 ° C)
Voi palvella sinua: Seleeni: historia, ominaisuudet, rakenne, hankkiminen, käyttöTällä tavoin saadaan β-CA3(PO4-A2, Yleisin ja vakaa polymorfisi.
Sovellukset
Luukudoksessa
CA3(PO4-A2 Se on luun tuhkan tärkein epäorgaaninen aineosa. Se on komponentti luun korvaussiirtoja, tämä selitetään sen kemiallisella samankaltaisuudella luussa olevien mineraalien kanssa.
Kalsiumfosfaatin biomateriaaleja käytetään luun vikojen korjaamiseen ja metalliproteesien peittämiseen. Kalsiumfosfaatti talletetaan niihin, eristäen ne ympäristöstä ja hidastaen titaanin korroosioprosessia.
Biokeraamiset sementit
Kalsiumfosfaattisementti (CPC) on toinen biokeramiikka, jota käytetään lukudoksen korjaamisessa. Sitä kehitetään sekoittamalla erityyppisten kalsiumfosfaattien pöly veden kanssa, muodostaen tahna. Pasta voidaan ruiskuttaa tai säätää luuvikalle tai ontelolle.
Sementit on muovattu, vähitellen imeytyneet ja ne korvataan vasta muodostetulla luulla.
Lääkärit
-CA3(PO4-A2 Se on emäksinen suola, joten sitä käytetään antasidina ylimääräisen mahalaukun happamuuden neutraloimiseksi ja pH: n lisäämiseksi. Hammaspasta toimittaa kalsiumin ja fosfaatin lähteen hampaiden ja luun hemostaasin remineralisaatioprosessin helpottamiseksi.
-Sitä käytetään myös ravitsemuslisäaineena, vaikka taloudellisin tapa toimittaa kalsiumia on käyttää sen karbonaattia ja sitraattia.
-Kalsiumfosfaattia voidaan käyttää Tethanyn, piilevän hypokalsemian ja ylläpitohoidon hoidossa. Lisäksi se on hyödyllinen kalsiumlisissä raskauden aikana ja imettämisessä.
-Sitä käytetään saastumisen hoidossa radioaktiivisella isotopos-radiolla (RA-226) ja strontiumilla (SR-90). Kalsiumfosfaatti estää radioaktiivisten isotopojen imeytymisen ruuansulatuksessa, mikä rajoittaa niiden aiheuttamia vaurioita.
Toiset
-Kalsiumfosfaattia käytetään lintujen rehuna. Lisäksi sitä käytetään hammaspastauksissa tartarin hallinnassa.
-Sitä käytetään anti -gomeranttiaineena, esimerkiksi estääksesi taulukon suolan kompaktiota.
-Se toimii jauhojen valkaisuna. Samaan aikaan kochinovoissa estää ei -toivottua väriä ja parantaa paistamisen tilaa.
Viitteet
- Kalsiumfosfaatti. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Kalsiumfosfaatti. Tiede suoraan. Haettu: ScienEdirect.com

