Lontoon joukot
- 1043
- 208
- Eddie Hackett
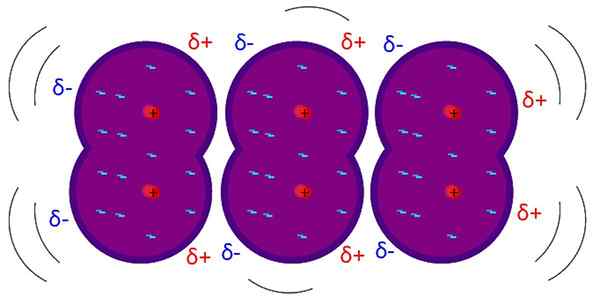
 Lontoon joukot ovat molekyylien välisiä heikkoja vuorovaikutuksia. Lähde: Riccardo Rovinetti, Wikimedia Commons
Lontoon joukot ovat molekyylien välisiä heikkoja vuorovaikutuksia. Lähde: Riccardo Rovinetti, Wikimedia Commons Mitkä ovat Lontoon joukot?
Se Lontoon joukot, Lontoon dispersiovoimat tai indusoidut dipolin vuorovaikutukset ovat heikoimpia molekyylien välisiä vuorovaikutuksia. Hänen nimensä johtuu teoreettisen fyysikon Fritz Lontoon (1900-1954) ja hänen opintojensa vaikutuksesta kvanttifysiikan alalla.
Lontoon joukot selittävät, kuinka molekyylit ovat vuorovaikutuksessa, joiden rakenteet ja atomit tekevät pysyvän dipolin muodostumisen; toisin sanoen, sovelletaan pohjimmiltaan apolaarisia molekyylejä tai atomeja, jotka on eristetty jalokaasuista.
Toisin kuin muut van der Waals -voimat, tämä vaatii erittäin lyhyitä matkoja.
Lontoon joukkojen ominaispiirteet
 Homogeenisten syytteiden jakautuminen. Lähde: Gabriel Bolívar
Homogeenisten syytteiden jakautuminen. Lähde: Gabriel Bolívar Mitä ominaisuuksia molekyylillä tulisi olla, jotta se voi olla vuorovaikutuksessa Lontoon joukkojen kautta? Vastaus on, että kuka tahansa voisi tehdä sen, mutta kun on pysyvä dipolimomentti, dipoli-dipolotyyppiset vuorovaikutukset ovat vallitsevia eikä dispersiota, mikä edistää hyvin vähän aineiden fyysistä luonnetta.
Rakenteissa, joissa ei ole kovin elektronegatiivisia atomeja tai joiden sähköstaattinen kuormituksen jakautuminen on homogeenista, ei ole loppua tai aluetta, jota voidaan pitää rikkaina (Δ-) tai huonoina (Δ+) elektroneissa.
Näissä tapauksissa muun tyyppisten voimien on puututtava tai muuten nämä yhdisteet voivat esiintyä vain kaasufaasissa riippumatta siitä, että ne toimivat jopa paine- tai lämpötilaolosuhteet.
Homogeeninen kuormitusjakauma
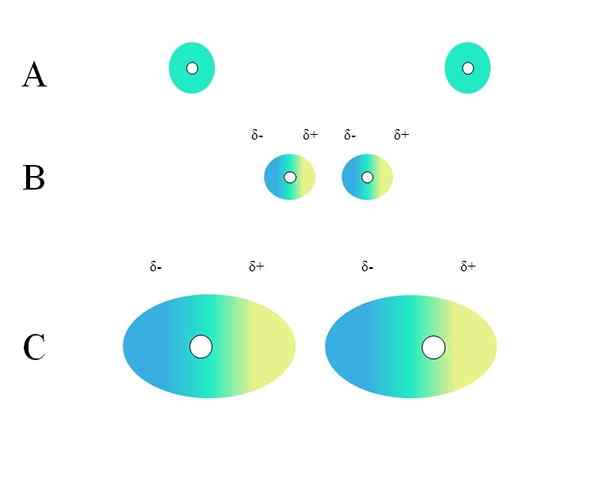
Kahdella eristetyllä atomilla, kuten neonilla tai argonilla, on homogeeninen kuormitusjakauma. Tämä näkyy, paremmassa kuvassa. Keskustan valkoiset ympyrät edustavat ytimiä, atomien tai molekyylin luurankoa molekyyleille. Tätä kuorman jakautumista voidaan pitää vihreiden elektronien pilvinä.
Miksi jalokaasut täyttävät tämän homogeenisuuden? Koska heidän elektronisen kerroksensa on täysin täynnä, niin heidän elektroniensa on teoreettisesti tuntea yhtäläisen ytimen kuorman vetovoima kaikilla kiertoradalla.
Toisaalta muille kaasuille, kuten atomi happi (O), sen kerros on epätäydellinen (mikä havaitaan sen elektronisessa kokoonpanossa) ja pakottaa sen muodostamaan diatomisen molekyylin tai2 Tämän puutteen kompensoimiseksi.
A -vihreät ympyrät voivat olla myös pieniä tai suuria molekyylejä. Sen kiertorata elektronit pilvisivät kaikkien atomien ympärillä, jotka tekevät siitä, etenkin kaikkein elektronegatiivisimmat. Näiden atomien ympärillä pilvi keskittyy ja on negatiivisempaa, kun taas muilla atomeilla on elektroninen puute.
Voi palvella sinua: ei -polaarinen kovalenttinen sidosTämä pilvi ei kuitenkaan ole staattinen, mutta dynaaminen, joten muodostuu jossain vaiheessa lyhyet alueet Δ- ja Δ+, ja nimeltään Will -ilmiö Polarisaatio.
Polarisoituvuus
Vihreässä pilvessä osoittaa homogeenisen negatiivisen kuormituksen jakautumisen. Ytimen aiheuttama positiivinen vetovoimavoima voi kuitenkin vaihdella elektroneihin. Tämä aiheuttaa pilven muodonmuutoksen, mikä luo Δ-alueet, sininen ja Δ+, keltainen.
Tämä atomin äkillinen dipolimomentti tai molekyyli voi vääristää viereistä elektronista pilviä; Toisin sanoen se indusoi äkillisen dipolin naapurinsa yli (B, ylivoimainen kuva).
Tämä johtuu siitä, että Δ-alue häiritsee viereistä pilviä, sen elektronit tuntevat sähköstaattisen heijastumisen ja ovat suunnattuja vastakkaiseen napaan, esiintyvät δ+.
Huomaa, kuinka positiiviset pylväät ovat linjassa negatiivisten kanssa, aivan kuten molekyylit pysyvien dipolimomenttien kanssa. Mitä laajempi elektroninen pilvi, sitä enemmän ydin ytimen pitää sen homogeenisena avaruudessa; Ja lisäksi se on sen muodonmuutos, kuten voidaan nähdä C: ssä.
Siksi pieniä atomeja ja molekyylejä ei todennäköisesti polarisoi ympäristön hiukkaset. Esimerkki tästä tilanteesta kuvaa pieni vetymolekyyli, H2.
Kyselyn tiivistäminen tai vieläkin enemmän tarvitsee kohtuuttomia paineita sen molekyylien pakottamiseksi fyysisesti vuorovaikutukseen.
On käänteisesti verrannollinen etäisyyteen
Vaikka muodostuu välittömiä dipoleja, jotka indusoivat muita heidän ympärillään, ne eivät riitä pitämään atomeja tai molekyylejä yhdessä.
B: ssä on etäisyys d -d joka erottaa kaksi pilviä ja niiden kaksi ydintä. Jotta molemmat dipolit voivat pysyä ajatellen, tämä etäisyys d -d Sen on oltava hyvin pieni.
Tämä ehto on täytettävä, Lontoon joukkojen olennainen ominaisuus (muista tarranauhan sulkeminen) siten, että pahamaineinen vaikutus asian fyysisiin ominaisuuksiin toimitetaan.
Kerran d -d Ole pieni, B: n vasemman ydin alkaa houkutella viereisen atomin tai molekyylin sinistä aluetta Δ-. Tämä muodostaa edelleen pilven, kuten voidaan nähdä C: ssä (ydin ei ole enää keskellä, vaan oikealla).
Voi palvella sinua: alkeenitSitten on kohta, jossa molemmat pilvet koskettavat ja "pomppia", mutta riittävän hitaasti saadakseen ne yhdessä ajankohtana.
Siksi Lontoon joukot ovat käänteisesti verrannollisia etäisyyteen d -d. Itse asiassa tekijä on yhtä suuri kuin d -d7, Joten sekä atomien tai molekyylien välisen etäisyyden minimaalinen variaatio heikentää tai vahvistaa Lontoon dispersiota.
Se on suoraan verrannollinen molekyylimassaan
Kuinka lisätä pilvien kokoa siten, että ne ovat helpommin polarisoituneita? Elektronien lisääminen ja sitä varten ytimessä on oltava enemmän protoneja ja neutroneja, mikä lisää atomimassaa; tai atomien lisääminen molekyylin luurankoon, mikä puolestaan lisäisi sen molekyylimassaa.
Tällä tavoin ytimet tai molekyylin luuranko pitävät vähemmän todennäköisesti elektronisen pilven koko ajan. Siksi mitä suuret vihreät ympyrät, jotka on tarkasteltu A, B ja C.
Tätä vaikutusta havaitaan selvästi B: n ja C: n välillä, ja se voi olla vielä enemmän, jos ympyrät olisivat halkaisijaltaan suurempia. Tämä päättely on avain monien yhdisteiden fysikaalisten ominaisuuksien selittämiseen niiden molekyylimassaan riippuen.
Esimerkkejä Lontoon joukkoista
 Luonnollinen esimerkki Lontoon voimista: Gecosin jalat
Luonnollinen esimerkki Lontoon voimista: Gecosin jalat Luonnossa
Jokapäiväisessä elämässä on lukemattomia esimerkkejä Lontoon dispersiovoimista ilman tarvetta uskaltaa ensisijaisesti mikroskooppista maailmaa.
Yksi yleisimmistä ja yllättävistä esimerkeistä löytyy Gecos -nimisen matelijoiden jalkoista (ylivoimainen kuva) ja monissa hyönteissä (myös Spidermanissa).
Jaloissaan heillä on joitain tyynyjä, joista tuhansia pieniä filamentteja erottuvat. Kuvassa näet gecon poseeraavan kallion kaltevuudella. Tämän saavuttamiseksi se käyttää molekyylien välisiä voimia kallion ja jalkojensa filamenttien välillä.
Jokainen näistä filamenteista on heikosti vuorovaikutuksessa pinnan kanssa, jonka läpi pieni matelija. GECO: t kykenevät myös kiivetä sileäksi ja täydellisille pinnoille, kuten kiteille.
Se voi palvella sinua: kaliumnitriitti (kno2): rakenne, ominaisuudet ja käytötSulkeutuu
Alkaanit ovat tyydyttyneitä hiilivetyjä, jotka myös ovat vuorovaikutuksessa Lontoon voimissa. Sen molekyylirakenteet koostuvat yksinkertaisesti hiilistä ja hydrogeista, jotka ovat yhdistäneet yksinkertaisilla siteillä. Koska elektronegatiivisuuden ero C: n ja H: n välillä on hyvin pieni, ne ovat apolaarisia yhdisteitä.
Siten metaani, cho4, Kaikkien pienin hiilivety, kiehuu -161.7. c. Kuten C ja H lisätään luurankoon, muut alkaanit saadaan korkeammilla molekyylimassoilla.
Tällä tavoin syntyy etaani (-88.6. c), butaani (-0.5. c) ja oktaani (125.7. c). Huomaa, kuinka niiden kiehumispisteet kasvavat, kun alkaanista tulee raskaampia.
Tämä johtuu siitä, että niiden elektroniset pilvet ovat polarisoitavampia ja niiden rakenteilla on suurempi pinnallinen alue, mikä lisää heidän molekyylien välistä kosketusta.
Oktaani, vaikka se on apolaarinen yhdiste, on kiehumispiste suurempi kuin vesi.
Halogeenit ja kaasut
Lontoon joukkoja on läsnä myös monissa kaasumaisissa aineissa. Esimerkiksi n molekyylit2, H2, Yhteistyö2, F2, Cl2 Ja kaikki jalokaasut ovat vuorovaikutuksessa näiden voimien läpi, koska niillä on homogeeninen sähköstaattinen jakauma, joka voi kärsiä tilannekuvaa ja aiheuttaa polarisaatioita.
Jalokaasut ovat hän (helium), neon (neon), AR (argon), Kr (Kripton), XE (Xenon) ja RN (radon). Vasemmalta oikealle niiden kiehumispisteet kasvavat atomimaisten lisääntyessä: -269, -246, -186, -152, -108 ja -62 ºC.
Halogeenit ovat myös vuorovaikutuksessa näiden voimien kautta. Fluori on kaasu huoneenlämpötilassa, aivan kuten kloori. Bromi, jolla on suurempi atomimassa, on normaaleissa olosuhteissa, kuten punertavan nesteen, ja jodi lopuksi muodostaa purppuran kiinteän aineen, joka sublimoi nopeasti, koska se on raskaampi kuin muut halogeenit.
Viitteet
- Whitten, Davis, Peck & Stanley. Kemia. (8. ed.-A. Cengage Learning, s. 452-455.
- Angeles Méndez. (22. toukokuuta 2012). Dispersiovoimat (Lontoosta). Palautettu: kemia.Laguia2000.com
- Lontoon dispersiovoimat. Palautettu: Chem.Purduke.Edu
- Helmestine, Anne Marie, PH.D -d. (22. kesäkuuta 2018). 3 molekyylien välistä voimaa. Toipunut: Admingco.com
- Ryan Ilagan & Gary L Bertrand. Lontoon dispersion vuorovaikutus. Otettu: Chem.Librettexts.org
- Kemia norialaiset. Lontoon joukot. Palautettu: Chem.WISC.Edu
- Kamereon. (22. toukokuuta 2013). Salamanqueas: GECO ja van der Waalsin voimat. Toipunut: Almabiologica.com

