Ihanteellinen kaasumalli, käyttäytyminen, esimerkit
- 2376
- 418
- Gustavo Runte DVM
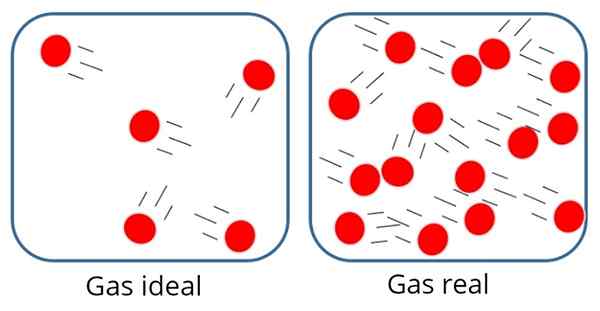
Eräs Ihanteellinen kaasu jompikumpi Täydellinen kaasu Se on sellainen, jossa vetovoiman tai molekyylin torjumisen voimaa pidetään merkityksettömänä sen säveltävien hiukkasten välillä, siksi kaikki sen sisäinen energia on kineettinen, ts.
Tällaisessa kaasussa hiukkaset ovat yleensä melko kaukana toisistaan, vaikkakin toisinaan törmäävät toisiinsa ja säiliön seinien kanssa.
 Ihanteellisessa kaasussa hiukkaset ovat poissa toisistaan
Ihanteellisessa kaasussa hiukkaset ovat poissa toisistaan Toisaalta, ihanteellisessa kaasussa hiukkasten koolla tai massalla ei ole merkitystä, koska niiden käyttämän tilavuuden oletetaan olevan hyvin pieni verrattuna itse kaasun tilavuuteen.
Tämä on tietysti vain lähestymistapa, koska todellisuudessa atomien ja molekyylien välillä on aina jonkin verran vuorovaikutusta. Tiedämme myös, että hiukkaset käyttävät tilaa ja niillä on massa.
Nämä oletukset toimivat kuitenkin monissa tapauksissa melko hyvin, kuten matalan molekyylipainon kaasut, hyvällä paine- ja lämpötilan alueella.
Korkean molekyylipainon kaasut, etenkin korkeissa paineissa tai matalissa lämpötiloissa, eivät kuitenkaan käyttäytyy ollenkaan ihanteellisina kaasuina ja tarvitsevat muita malleja, jotka on luotu kuvaamaan niitä suuremmalla tarkkuudella.
[TOC]
Ensimmäiset kokeet
Kaasuja hallitsevat lait ovat empiirisiä, ts. Ne syntyivät kokeilusta. Merkittävimmät kokeet suoritettiin seitsemännentoista, kahdeksastoista ja 1800 -luvun alkupuolella.
Ensinnäkin ovat Robert Boyle (1627-1691) ja Edme Mariotte (1620-1684), jotka muokkasivat itsenäisesti paine kaasussa ja rekisteröi muutoksen tilavuus, toteaa, että ne olivat käänteisesti verrannollisia: suuremmassa paineessa, vähemmän tilavuus.
 Robert Boyle
Robert Boyle Jacques Charles (1746-1823) osoitti puolestaan kyseisen määrän ja lämpötila absoluuttinen oli suoraan verrannollinen, kunhan paine pysyi vakiona.
Se voi palvella sinua: paikallaan olevat aallot: kaavat, ominaisuudet, tyypit, esimerkitAmadeo Avogadro (1776-1856) havaitsi, että kaksi identtistä määrää eri kaasuja sisälsi saman määrän hiukkasia, kunhan paine ja lämpötila olivat samat. Ja lopuksi Joseph de Gay Lussac (1778-1850), sanoi, että pitämällä tilavuus kiinteänä paine kaasussa on suoraan verrannollinen lämpötilaan.
Ihanteellisten kaasujen lait
Nämä löytöt ilmaistaan yksinkertaisten kaavojen avulla, soittaminen p painetta, V tilavuus, n hiukkasten lukumäärään ja T Ihanteellinen kaasun lämpötila:
Boyle-Maleotte Law
Edellyttäen, että lämpötila on kiinnitetty, seuraava:
P⋅V = vakio
Charles Law
Kun kaasu on jatkuvassa paineessa:
V / t = vakio
Gay Lussacin laki
Kaasun pitäminen kiinteässä tilavuudessa on totta, että:
p / t = vakio
Avogadro -laki
Identtiset kaasumäärät samassa paine- ja lämpötila -olosuhteissa on sama lukumäärä hiukkasia. Siksi voimme kirjoittaa:
V ∝ n
Missä n on hiukkasten lukumäärä ja ∝ on suhteellisuuden symboli.
Ihanteellinen kaasumalli
Ihanteellinen kaasumalli kuvaa kaasua siten, että:
-Kun hiukkaset ovat vuorovaikutuksessa, tee niin hyvin lyhyen ajan, elastisten yhteenottojen kautta, joissa sysäys ja kineettinen energia säilytetään.
-Sen ainesosat ovat täsmällisiä, toisin sanoen sen halkaisija on paljon pienempi kuin keskimääräinen etäisyys, jota ne kulkevat yhden ja toisen törmäyksen välillä.
-Molekyylienväliset voimat eivät ole olemassa.
-Kineettinen energia on verrannollinen lämpötilaan.
Monoatomisia kaasuja - joiden atomit eivät ole kytketty toisiinsa - ja pienimolekyylipainoihin, paineen ja lämpötilan tavanomaisissa olosuhteissa (ilmakehän paine ja 0 º C lämpötila), niillä on sellainen käyttäytyminen, että ihanteellinen kaasumalli on erittäin hyvä kuvaus niitä.
Se voi palvella sinua: Vy canis majoris: löytö, ominaisuudet, rakenne, koulutus ja evoluutioIhanteellinen kaasun tilayhtälö
Yllä olevien kaasujen lait yhdistetään muodostamaan yleinen yhtälö, joka säätelee ihanteellista kaasun käyttäytymistä:
V ∝ n
V ∝ t
Siksi:
V ∝ N⋅T
Lisäksi Boylen laista:
V = vakio / p
Sitten voimme vahvistaa sen:
V = (vakio x n⋅t) / p
Vakiona kutsutaan kaasuvakio Ja sitä merkitään kirjaimella r. Tämän valinnan avulla ihanteellinen kaasuyhtälö liittyy neljää muuttujaa, jotka kuvaavat kaasun tilaa, nimittäin n, r, p ja t, jättäen:
P⋅V = n⋅r⋅t
Tämä suhteellisen yksinkertainen yhtälö on yhdenmukainen ihanteellisten kaasujen lakien kanssa. Esimerkiksi, jos lämpötila on vakio, yhtälö pelkistetään Boyle-Maleotte-lakiin.
Kaasuvakio
Kuten olemme aiemmin sanoneet, tavanomaisissa lämpötila- ja paineolosuhteissa, ts. 0ºC (273.15 k) ja 1 paineilmapiiri, monien kaasujen käyttäytyminen on lähellä ihanteellista kaasua. Näissä olosuhteissa 1 mol kaasua on 22.414 l.
Siinä tapauksessa:
R = (p⋅V) / (n⋅t) = (1 atm x 22.414 l) / (1 mol x 273.15 k) = 0.0821 atm ⋅ l /mol ⋅ k
Kaasuvakio voidaan ilmaista myös muissa yksiköissä, esimerkiksi kansainvälisessä järjestelmässä, jos se on arvoinen:
R = 8 314 j⋅ mol-1⋅ K-1
Kun ongelma ratkaistaan ihanteellisen kaasulakin avulla, on kätevää kiinnittää huomiota yksiköihin, joissa vakio ilmaistaan, koska kuten voimme nähdä, on monia mahdollisuuksia.
Ihanteellisen kaasun käyttäytyminen
Kuten olemme sanoneet, mikä tahansa vakiopaine- ja lämpötilaolosuhteiden kaasu, joka on pieni molekyylipaino, käyttäytyy hyvin lähellä ihanteellista kaasua. Siksi yhtälö P⋅V = N⋅R⋅T: tä on sovellettavissa etsimään sitä kuvaavien neljän muuttujan välillä: n, p, v ja t.
Se voi palvella sinua: Heisenberg Atomic -malliTällä tavoin voimme kuvitella ihanteellisen kaasuosuuden, joka on lukittu astiaan ja muodostaa pienet hiukkaset, jotka toisinaan törmäävät toisiinsa ja astian seinien kanssa, aina joustavasti.
Tätä näemme seuraavan helium -osan animaatiossa, jalo- ja monoatomisessa kaasussa:
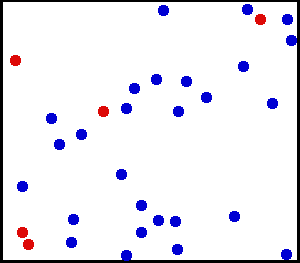 Helium on jalokaasu, animaatiossa osa heliumiatomeista on esitetty säiliössä. Punaiset palvelevat paremmin liikettä. Lähde: Wikimedia Commons.
Helium on jalokaasu, animaatiossa osa heliumiatomeista on esitetty säiliössä. Punaiset palvelevat paremmin liikettä. Lähde: Wikimedia Commons. Esimerkkejä ihanteellisista kaasuista
Ihanteellinen kaasu on hypoteettinen kaasu, toisin sanoen se on idealisointi, mutta käytännössä monet kaasut käyttäytyvät hyvin läheisellä tavalla, mikä mahdollistaa P⋅V -mallin = N⋅R⋅T tarkka.
jalokaasut
Esimerkki kaasuista, jotka käyttäytyvät ihanteina tavanomaisissa olosuhteissa, ovat jaloja kaasuja sekä kevyitä kaasuja: vety, happi ja typpi.
Aerostaattinen ilmapallo
 Ihanteellinen kaasumalli selittää kuinka kuuma ilmapallo. Lähde: Wikimedia Commons.
Ihanteellinen kaasumalli selittää kuinka kuuma ilmapallo. Lähde: Wikimedia Commons. Kuvion 1 aerostaattiseen ilmapalloon voidaan soveltaa Charlesin lailla: kaasua lämmitetään, joten maapallon täyttävä ilma laajenee ja sen seurauksena se nousee.
Heliumpallot
Helium on yhdessä vedyn kanssa yleisin elementti maailmankaikkeudessa, ja silti sitä on vähän maan päällä. Koska jalokaasu on inertti, toisin kuin vety, niin helium -täydet ilmapallot käytetään laajalti koristeellisinä elementeinä.
Viitteet
- Atkins, p. 1999. Fysikaalinen kemia. Omega -versiot.
- Chang, R. 2013. Kemia. 11Va. Painos. MC Graw Hill Education.
- Cengel, ja. 2012. Termodynamiikka. 7. painos. McGraw Hill.
- Cimbala, c. 2006. Nesteiden, perusteiden ja sovellusten mekaniikka. MC. Graw Hill.
- Giambattista, a. 2010. Fysiikka. Toinen. Ed. McGraw Hill.
- « Luonnonympäristön ominaisuudet, elementit, merkitys, esimerkit
- Melkeysiesimerkit ja ominaisuudet »

