Kemiallinen hybridisaatio

- 4861
- 239
- Edgar VonRueden
Mikä on kemiallinen hybridisaatio?
Se Kemiallinen hybridisaatio Se on atomiorbitaalien "seos", jonka konseptin kemisti Linus Pauling esitteli vuonna 1931 kattaakseen Valencian linkkiteorian puutteet (TEV). Mitkä puutteet? Nämä ovat: molekyyligeometriat ja vastaavat yhteydet molekyyleissä, kuten metaanissa (CH4-A.
TEV: n mukaan metaanissa C: n atomiorbitaalit muodostavat neljän σ -yhteyden neljään H -atomiin. Orbitaalit 2p, C: n (alempi kuva) muodot (alempi kuva) ovat kohtisuorassa toisiinsa nähden, joten H tulisi poistaa toisistaan 90º: n kulmassa.

Lisäksi 2: n (pallomainen) kiertoradan. Kokeellisesti on kuitenkin havaittu, että CH: n kulmat4 Ne ovat 109,5º ja että C-H-linkkien pituudet ovat ekvivalentteja.
Tämän selittämiseksi alkuperäisten atomiorbitaalien yhdistelmän on katsottava muodostavan neljä rappeutunutta hybridi -kiertorataa (yhtä energiaa). Tässä kemiallinen hybridisaatio tulee peliin. Kuinka hybridi -kiertoradat ovat? Se riippuu niiden tuottavista atomisiorbitaaleista. Niillä on myös sekoitus näiden elektronisia ominaisuuksia.
SP3
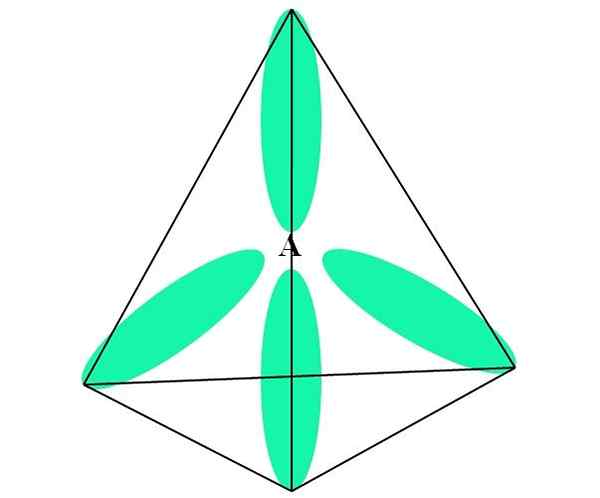
CH: n tapauksessa4, C -hybridisaatio on SP3. Tästä lähestymistavasta molekyyligeometria selitetään neljällä SP -kiertoradalla3 Erotettuna 109,5º: ssa ja osoittaen kohti tetraedron huippuja.
Yläkuvassa näet kuinka orbitaalit sp3 (vihreä) Luo tetraedrinen elektroninen ympäristö atomin ympärille (A, joka on C CH: lle4-A.
Voi palvella sinua: amiesitMiksi 109,5º eikä muilla kulmilla, "piirtää" erilainen geometria? Syynä johtuu siitä, että tämä kulma minimoi niiden neljän atomin elektroniset torjut.
Tällä tavalla Cho: n molekyyli4 Sitä voidaan edustaa tetraedrina (tetraedrinen molekyyligeometria).
Jos H: n sijasta C muodosti yhteydet muihin atomien ryhmiin, mikä sen hybridisaatio olisi sitten? Edellyttäen, että hiilimuoto neljä linkkiä σ (c-a), sen hybridisaatio on SP3.
Voidaan johdonmukaisesti olettaa, että muissa orgaanisissa yhdisteissä, kuten ch3Voi, ccl4, C (CH3-A4, C6H12 (syklohexan) jne., Hiilellä on SP -hybridisaatio3.
Tämä on välttämätöntä orgaanisten rakenteiden luonnostelemiseksi, joissa hiilet, joissa on yksinkertaiset linkit, edustavat divergenssipisteitä; toisin sanoen rakenne ei pysy yhdessä tasossa.
Tulkinta
Mikä on yksinkertaisin tulkinta näille hybridi -orbitaaleille käsittelemättä matemaattisia näkökohtia (aaltotoiminnot)? Orbitaalit sp3 He viittaavat siihen, että ne olivat peräisin neljällä kiertoradalla: yksi s ja kolme p.
Koska näiden atomiorbitaalien yhdistelmä on tarkoitus olla ihanteellinen, neljän SP -kiertoradan3 Tuloksena olevat ovat identtisiä ja vievät erilaisia avaruuksien suuntauksia (kuten orbitaaleissa px, pja Ja pz -z-A.
Edellä olevaa voidaan soveltaa muihin mahdollisiin hybridaatioihin: muodostettujen hybridi -kiertoratojen lukumäärä on sama kuin yhdistävien atomien kiertoratojen lukumäärä. Esimerkiksi sp híbridos Orbital3d -d2 Ne on muodostettu kuudesta atomiorbitaalista: yksi s, kolme p ja kaksi d.
Poikkeamat linkkikulmista
Valencia -kerroksen elektronisten parien torjuntateorian (RPECV) mukaan pari vapaata elektronia on enemmän kuin kytketty atomi. Tämä aiheuttaa linkit liikkumaan pois, vähentämällä elektronista jännitystä ja ohjaamalla 109,5º: n kulmat:
Se voi palvella sinua: Crucible for Crucible: Ominaisuudet, toiminnot, käytä esimerkkejä
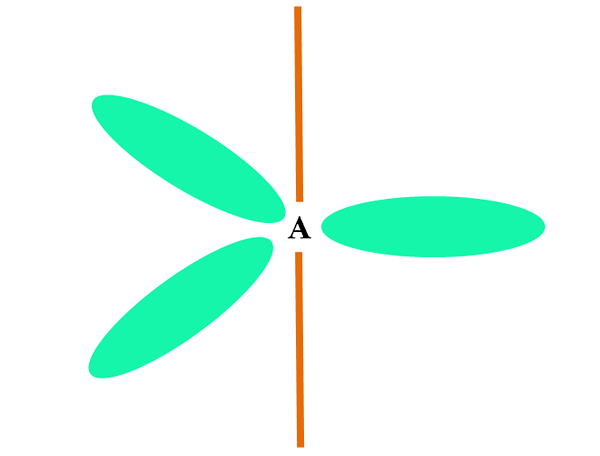
Esimerkiksi vesimolekyylissä H: n atomit on kytketty Orbitals SP: hen3 (vihreänä), ja myös elektronien parit, joita ei jaettu ":" vie nämä kiertoradat.
Näiden elektroniparien torjunnot esitetään yleensä "kahdella ilmapallolla, joissa on silmät", jotka niiden tilavuuden vuoksi torjuvat kaksi linkkiä σ O-H.
Siten vedessä linkkien kulmat ovat todella 105º, tetraedrisen geometrian odotettavissa olevien 109,5º: n sijasta.
Mitä geometriaa h: lla on2JOMPIKUMPI? On kulmageometria. Koska? Koska elektroninen geometria on tetraedrinen, kaksi paria ei jaettuja elektroneja vääristävät sen kulma -molekyylin geometriaksi.
SP2
Kun atomi yhdistää kaksi tai S -kiertorataa, se tuottaa kolme hybridi -orbitaalia SP: tä2; Orbitaali P (koska niitä on kolme) pysyy kuitenkin muuttumattomana, mikä on edustettuna oranssina palkina ylemmässä kuvassa.
Täällä kolme kiertorataa sp2 Ne ovat vihreitä korostaakseen eroa oranssista palkista: kiertoradan p "puhdas".
Atomi SP -hybridisaatiolla2 Se voidaan visualisoida trigonaaliseksi litteäksi lattiaksi (SP -orbitaalien kanssa piirretty kolmio2 vihreä), kun sen kärkipisteet on erotettu 120º kulmalla ja kohtisuorassa palkkiin asti.
Ja mikä rooli kiertoradan puhdasta pelaaminen on? Kaksoissidoksen muodostaminen (=). Orbitaalit sp2 Ne sallivat kolmen linkin σ muodostumisen, kun taas kiertoradan puhdas P -sidos π (kaksois- tai kolminkertainen linkki sisältää yhden tai kaksi linkkiä π).
Esimerkiksi karbonyyliryhmän ja formaldehydimolekyylin rakenteen piirtäminen (H2C = o), se jatkuu seuraavasti:
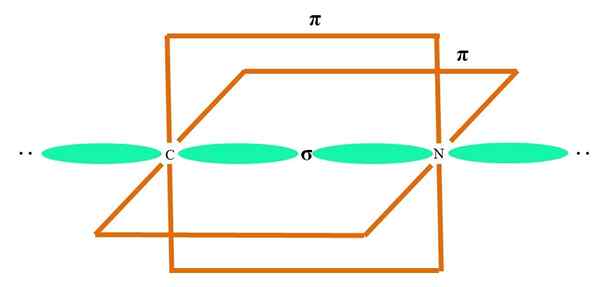
Se voi palvella sinua: sykopropaani (C3H6)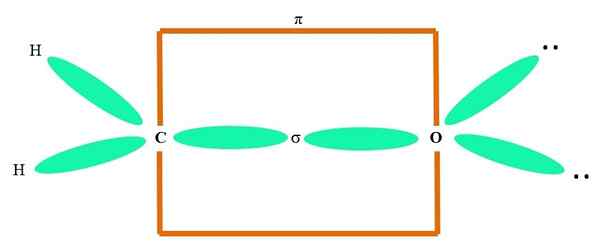
Orbitaalit sp2 Sekä C että O muodostavat linkin σ, kun taas sen puhtaat orbitaalit muodostavat π -sidoksen (oranssi suorakulmio).
Voidaan huomata, kuinka muut elektroniset ryhmät (H -atomit ja ei jaetujen elektronien parit) sijaitsevat muissa SP -orbitaaleissa2, erotettu 120º: lla.
SP
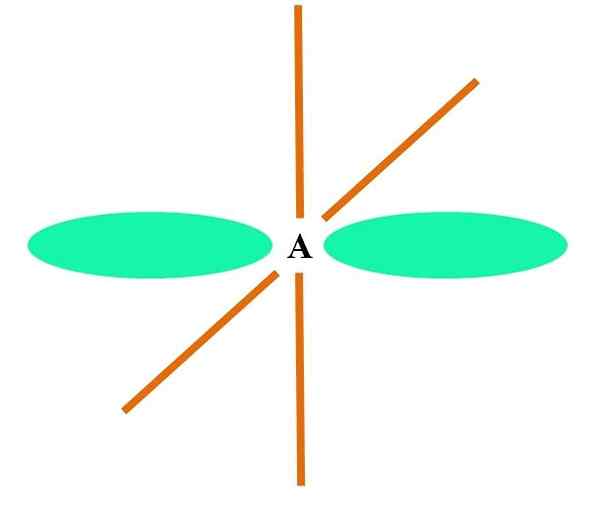
Ylemmässä kuvassa atomi havainnollistetaan SP -hybridisaatiolla. Tässä kiertorata s ja kiertorata p. Kaksi puhdasta kiertoradan kiertorataa on kuitenkin nyt muuttumaton, mikä antaa niiden muodostamaan kaksi kaksoislinkkiä tai kolminkertaisen linkin (≡).
Toisin sanoen: Jos rakenteessa A C on yllä olevaa (= c = o c irti), sen hybridisaatio on SP. Muille vähemmän havainnollisille atomeille - kuten siirtymämetalleille - elektronisten ja molekyyligeometrioiden kuvaus on monimutkainen, koska myös orbitaalit d ja jopa F otetaan huomioon.
Hybridi -orbitaalit erotetaan kulmassa 180º. Tästä syystä kytketyt atomit on järjestetty lineaariseen molekyyligeometriaan (B-A-B). Lopuksi, alemmassa kuvassa syanidianionirakenne voidaan nähdä: