Hydratsiinirakenne, ominaisuudet, synteesi, käyttää

- 2979
- 173
- Joshua Emmerich
Se Hydratsiini Se on epäorgaaninen yhdiste, jonka kemiallinen kaava on n2H4. Se koostuu typpihydrorien perheenjäsenestä, yksinkertaisin on yksinkertaisin kaikista olemuksista. Vaikka sen molekyyli näyttää yksinkertaisuudesta, sillä on useita kemiallisia ja fysikaalisia ominaisuuksia, jotka tekevät hydratsiinista mielenkiintoisen ja energisesti lupaavan aineen.
Pidä läheisesti samankaltaisuus veden kanssa, koska molemmat esiintyvät nestemäisinä aineina samanlaisissa lämpötiloissa. Hydratsiinista voimme saada orgaanisia johdannaisia korvaamalla sen hydrogenssit hiilihapotetuilla ryhmillä. Lisäksi siitä syntetisoidut hydratsonit, hydratsidit ja hydratsiinisuolat.
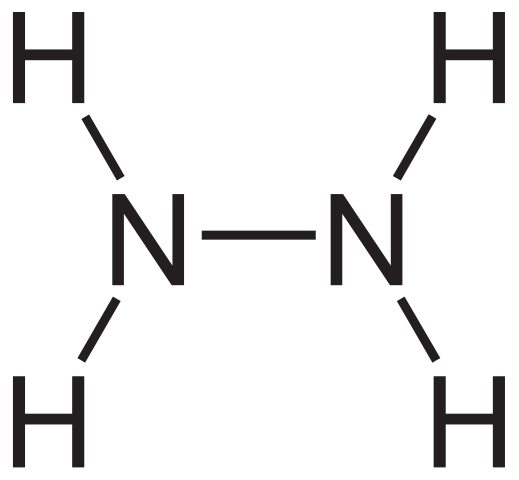 Hydratsiinirakenteinen kaava. Lähde: Neurotoger Wikipedian kautta.
Hydratsiinirakenteinen kaava. Lähde: Neurotoger Wikipedian kautta. Hydratsiinin rakenteellinen kaava voidaan nähdä yllä, joka voidaan kirjoittaa h2Nnh2 tai h2N-NH2. Jos katsot huolellisesti, näyttää siltä, että kaksi NH -molekyyliä3 He olisivat linkittäneet toisiinsa. N-N-linkin muodostumisessa ei kuitenkaan ole vain ammoniakkimolekyylejä reagenssina.
Hydratsiini on yhdiste, jolla on useita sovelluksia, koska se on erinomainen edeltäjä yhdisteiden sinfiineille, sekä orgaaninen että epäorgaaninen. Samoin sen pelkistävän voiman ja hajotustuotteiden ansiosta sen tarkoituksena on poistaa happi ja muut kaasut, saada jalometalleja; Ja etenkin avaruusaluksen ja valtion -asteen lentokoneiden lisäämiseksi.
[TOC]
Hydrasiinirakenne
Molekyyli ja linkki
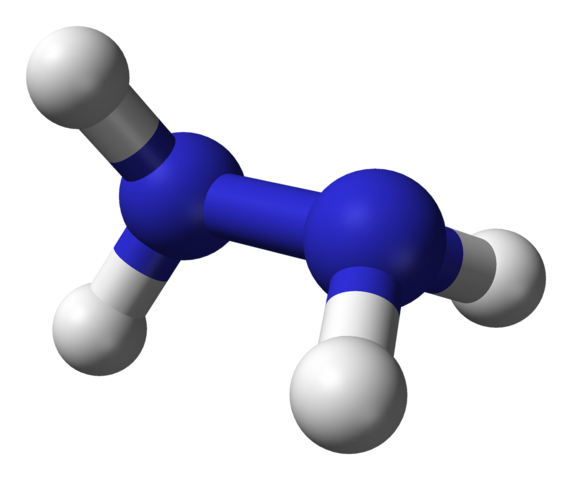 Hydratsiinin molekyylirakenne. Lähde: Ben Mills Wikipedian kautta.
Hydratsiinin molekyylirakenne. Lähde: Ben Mills Wikipedian kautta. Yläkuvassa on hydratsiinimolekyyli, jota edustavat pallot ja baarimalli. Huomaa, että vetyatomien, valkoisten pallojen alueellinen suuntaus on ristiriidassa rakenteellisen kaavan tarjoaman vaikutelman kanssa; eli molempien -nh -vety2 Niitä ei ole kohdistettu tai varjostettu, mutta niiden kiertokulma on 95º.
Itse asiassa on niin paljon, että N-N-linkki ei tuskin pysty kiertämään, sillä sillä on energiaeste, jonka on vanhentunut neljän vetyatomin pimennys.
Mitä tämä on? Periaatteessa vahvoille elektronisille torjunnoille, jotka molemminpuolisesti kokevat kaksi yksinäisiä elektronien paria typpiatomeissa. Tämä 95º kulma antaa hydratsiinimolekyylin suurimman stabiilisuuden.
Voi palvella sinua: litiumbromidi: rakenne, ominaisuudet, käytöt, riskitGeometriat
Jokaisella typpiatomilla on SP -hybridisaatio3, Kolmiomaisen pyramidin geometrian omaksuminen. Siksi vapaiden elektronien parien kanssa hydrasiinimolekyyli, kuten kaksi sen kärjessä kytkettyä pyramidia, voitaisiin visualisoida ja joiden keskuksissa typpiatomit sijaitsevat.
Molekyylien väliset vuorovaikutukset
Kaava H2Nnh2 Voisin antaa väärän kuvan siitä, että hydratsiini on apolaarinen yhdiste, jolla on kaksi yhtä suurta ryhmää. Molekyylirakenne ja sen pyöritetty N-N-sidos osoittavat kuitenkin, että molekyyli ei ole täysin symmetrinen, ja mainitsee myös, että niiden vapaat elektroniparit eivät osoita päinvastaisiin suuntiin.
Tämä tarkoittaa, että hydratsiini, joka on rakenteellisesti ja elektronisesti epäsymmetrinen, esittelee dipolimomentin. Ja siksi niiden molekyylit ovat vuorovaikutuksessa toistensa kanssa dipolin avulla2Nnh2-Nh2Nh2, jotka ovat vastuussa hydratsiinista, jolla on erittäin korkea kiehumispiste.
Hydrasiinin ominaisuudet
 Hydratsiinihydraatti. Lähde: LHCHEM/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0)
Hydratsiinihydraatti. Lähde: LHCHEM/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0) Fyysinen ulkonäkö
Hydratsiini on väritön neste, joka on samanlainen kuin vettä viskositeetin ja tiheyden suhteen. Kun poltetaan, se emittoi valkoisia höyryjä, ammoniakin ja kalan lisäksi.
Moolimassa
32.0452 g/mol
Sulamispiste
2 ºC.
Kiehumispiste
114 ºC. Huomaa, että hydratsiini esiintyy nestemäisessä tilassa lämpötilavälillä 2-114 ºC, hyvin samanlainen kuin veden, 0-100 ºC.
Tiheys
1.021 g/cm3
Höyrytiheys
1.1 Airisuhteessa.
Höyrynpaine
Noin 0.010 ATM 30.7 ºC
Liukoisuus
Hydratsiini sekoittuu veden kanssa, samoin kuin useiden primaaristen alkoholien kanssa. Hydratsiini muodostaa hydraatin vedellä, n2H4· H2Tai, jolle on ominaista tiheämpi kuin puhdas tai vedetön hydratsiini. Tämä hydraatti on markkinoin tuote, koska se on vakaampi ja halpoja.
Dipolaarinen hetki
1.85 d. Se on melko polaarinen aine, melkein sama kuin vesi.
Se voi palvella sinua: Yodiumhappo (HIO3): rakenne, ominaisuudet, riskit ja käyttötarkoituksetGoo
0 -.876 CP
Leimahduspiste
52 ºC
Itsensuuntainen lämpötila
Vaihtelee riippuen aineista tai pinnoista, joiden kanssa se joutuu kosketuksiin. Esimerkiksi rautaoksidit palaavat 23 ° C: ssa, kun taas lasissa tai muissa säiliöissä se ei alkaa tulehtua ennen kuin 270 ºC.
Hajoaminen
Kun se palaa ilmassa, se hajoaa typpioksideissa, eix. Mutta sen katalyyttisen hajoamisen, toisin sanoen metallioksidien tai metallin kiihdyttämisen, tuotteet, kuten ammoniakki, typpi ja vety, ja valtava määrä lämpöä, joka lopulta muodostaa palavan, mutta näkymättömän liekin.
Reaktiivisuus
Hydratsiini on hyvä pelkistävä aine, koska hapettumisen jälkeen tuottaa vettä ja typpeä, molemmat yhdisteet, jotka eivät kärsi toissijaisista reaktioista.
Toisaalta hydratsiini on nukleofiili, koska se käyttää vapaiden elektroniensa pareitaan liittymään muihin orgaanisiin molekyyleihin. Samoin se voi kärsiä korvata3, Metyloitujen johdannaisten tuottaminen: CH3Nhnh2 tai (ch3-A2Nnh2.
Reagoi vahvojen happojen kanssa muodostamaan Hidrazinio -suoloja, n2H5X, ja Hidrazoniosta, n2H6X2. Jälkimmäiset ovat vähiten yleisiä. Hydratsiniumsulfaatti, [n2H5] HSO4, Se valmistetaan reagoimalla hydratsiinihydraatti rikkihapolla.
Perusteetti
Hydratsiini on heikompi emäs kuin ammoniakki:
N2H4(AC) + H2Tai (l) ⇌ n2H5+(AC) + OH-(AC)
K -k -b - = 1.3 · 10-6
Tämä johtuu siitä, että hydratsiniokonjugaattihappo2H5+ tai h3N+-Nh2, on NH -ryhmän vetovoimavaikutus epävakauttanut kuormansa2; toisin sanoen sen sijaan, että tarjottaisiin elektroninen tiheys positiiviselle typelle.
Hydratsiini kykenee kärsimään toisen, paljon vähemmän todennäköisen protonoinnin, joka tuottaa vielä epävakaamman konjugoidun hapon:
N2H5+(AC) + H2Tai (l) ⇌ n2H6+(AC) + OH-(AC)
K -k -b - = 8.4 · 10-16
Hydrazonium, n2H6+ tai h3N+-N+H3, Se on erittäin epävakaa, koska molempien typpiatomien positiivisten kuormitusten välinen torjuminen. Tiettyjen anionien seurassa se voi kuitenkin olla suolana.
Myrkyllisyys
Anhydra -hydratsiini on erittäin myrkyllinen, kaustinen ja mahdollisesti syöpää aiheuttava aine, puhumattakaan siitä, että se on erittäin räjähtävä, joten sitä tulisi manipuloida vain tiukkojen turvallisuusprotokollien alla.
Voi palvella sinua: Pakkauskerroin: Kuinka laskea, esimerkkejä ja harjoituksiaSynteesi
Hydratsiinin syntetisointiin eniten käytetty menetelmä on Raschig -prosessi. Tämä koostuu seuraavista kahdesta reaktiosta:
Nh3(AC) + Naocl (AC) → NH2Cl (AC) + NaOH (AC)
2NH3(AC) + NH2Cl (ac) → n2H4(AC) + NH4Cl (AC)
Lopulta muodostuu hydraatti n2H4· H2Tai, joka on tislattu KOH: n tai NaOH: n läsnä ollessa kuivina kiinteinä aineina:
N2H4· H2O → n2H4
Tällä tavalla saadaan anhydra-hydratsiini ja N-N-linkki muodostetaan.
Hydratsiini käyttää
 Hydratsiini on yksi Aerospace Boomin arvostetuimmista aineista. Lähde: Pxhere.
Hydratsiini on yksi Aerospace Boomin arvostetuimmista aineista. Lähde: Pxhere. - Hydratsiini, metallikatalyyttien läsnä ollessa, hajoaa eksotermaisesti typen ja vedyn tuottamiseksi, mikä tarjoaa tarpeeksi energiaa lentokoneiden, rakettien ja satelliittien lisäämiseksi.
- Tätä taipumusta hajottaa ja aiheuttaa kaasuja tarkalleen polymeeristen materiaalien, kuten kumin tai polyeteenin, täyttämiseen, niiden muuttamiseen vastaaviin vaahtoihin.
- Samoin kaasut vapauttamalla nämä voivat vetää muita putkien putkiin liuenneena, joten on erittäin hyödyllistä eliminoida happi kattiloista, välttäen siten, että ne syövyttävät.
- Hydratsiini on edeltäjä materiaali monille orgaanisille yhdisteille, joilla on farmakologisia toimintoja, sifungisidejä, rikkakasvien torjunta -aineita, hyönteismyrkkyjä, lannoitteita jne. Tämä johtuu siitä, että syntetisoidaan monenlaisia syklisiä typpijohdannaisia.
- Lopuksi, koska se on hyvä pelkistävä aine, hydratsiinia ja sen hydratsiniumsuoloja käytetään jalometallimineraalien vähentämiseen, mikä on arvokasta metallurgista teollisuutta.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2020). Hydratsiini. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2020). Hydratsiini. Pubchem Comunundin yhteenveto CID 9321: lle. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Enyclopaedia Britannica -toimittajat. (2020). Hydratsiini. Britannica Encyclopaedia. Toipunut: Britannica.com
- Iridium Seuraava. (20. kesäkuuta 2017). Hydratsiini - myrkyllinen ihmisille, mutta satelliitit rakastavat sitä. Toipunut: Iridium.com

