Katalyyttinen hydraus
- 3333
- 676
- Arthur Terry II
 Katalyyttinen hydraus on kemiallinen reaktio, jossa lopullinen tulos on vedyn lisääminen toiseen yhdisteeseen. Lähde: Gabriel Bolívar
Katalyyttinen hydraus on kemiallinen reaktio, jossa lopullinen tulos on vedyn lisääminen toiseen yhdisteeseen. Lähde: Gabriel Bolívar Mikä on katalyyttinen hydraus?
Se katalyyttinen hydraus Se on kemiallinen reaktio, jolla molekyylin vety lisätään yhdisteeseen suuremmilla nopeuksilla.
H -molekyyli2 Sen ei vain saa katkaista kovalenttisen sidoksensa, vaan myös niin pienet, tehokkaat törmäykset sen ja yhdisteen välillä siihen, mihin se lisätään.
Vetyreseptoriyhdiste voi hyvinkin olla orgaaninen tai epäorgaaninen. Orgaanisissa yhdisteissä ne ovat siellä, missä on eniten esimerkkejä katalyyttisestä hydrauksesta, etenkin sellaisista, joilla on farmakologista aktiivisuutta, tai niiden rakenteisiin sisällytetään metalleja (organometalliset yhdisteet).
Kun h lisätään2 Hiilen täynnä olevaan rakenteeseen tapahtuu, että sen tyydyttymättömyys vähenee, ts. Hiili saavuttaa sen muodostavien yksinkertaisten linkkien maksimaalisen asteen.
Siksi h2 Kaksinkertaiset (c = c) ja kolminkertaiset (C≡C) linkit lisätään, vaikka se voidaan lisätä myös hiiliryhmiin (C = O).
Siten alkeenit ja alkines reagoivat katalyyttisen hydrauksen avulla. Minkä tahansa rakenteen pinnallisesti analysoimalla voidaan ennustaa, lisääkö se vai ei H2 Tunnista vain kaksois- ja kolminkertaiset linkit.
Katalyyttisen hydrauksen ominaisuudet
Kuva näyttää tämän reaktion mekanismin. On kuitenkin tarpeen käsitellä joitain teoreettisia näkökohtia ennen sen kuvaamista.
Harmaan pallon pinnat edustavat metalliatomeja, jotka, kuten nähdään, ovat hydrauksen katalyyttejä par excellence.
Vety sidos repeämät
- Hydraus on eksoterminen reaktio, ts. Se vapauttaa lämpöä pienemmän energian yhdisteiden muodostumisen seurauksena.
Voi palvella sinua: asetanylidi (C8H9NO)- Muodostuneet C-H-sidokset ovat stabiileja, jotka vaativat suurempaa energiaa myöhempää repeämää varten kuin molekyylin vetytarpeiden H-H-sidos.
- Hydraus sisältää aina ensin H-H-linkin repeämä. Tämä repeämä voi olla homoliittinen, kuten monissa tapauksissa:
H-H => H ∙ + ∙ H
Tai heterolyyttinen, joka voidaan antaa esimerkiksi sinkkioksidia vetyä, ZnO:
H-h => h+ + H-
- Ero kahden repeämän välillä on siinä, kuinka linkkielektronit jakautuvat. Jos ne jakautuvat tasaisesti (kovalenttisesti), jokainen H lopulta säilyttää elektronin, kun taas jakauma on ioninen, yksi päättyy ilman elektroneja, H+, Ja toinen voittaa heidät kokonaan, H-.
- Molemmat repeytykset ovat mahdollisia katalyyttisessä hydrauksessa, vaikka homoliittinen sallii antaa tien tämän loogisen mekanismin kehittämiselle.
Koe-
- Vety on kaasu, ja siksi sen on oltava kuplivaa ja taataan, että vain hän hallitsee nesteen pinnalla.
- Vetyyhdiste on liuotettava väliaineeseen, olipa se sitten vesi, alkoholi, eetteri, esterit tai nestemäinen amiini. Muuten hydraus kulkee hyvin hitaasti.
Liuennut yhdiste vetyen, reaktioväliaineessa on myös oltava katalyytti. Tämä vastaa reaktion nopeuden nopeuttamisesta.
- Katalyyttisessä hydrauksessa käytetään yleensä hienosti jaettuja metalleja nikkeli-, paladium-, platina- tai rodiummetalleja, jotka ovat liukenemattomia melkein kaikkiin orgaanisiin liuottimiin. Siksi tulee olemaan kaksi faasia: neste liuenneen yhdisteen ja vedyn kanssa ja kiinteä katalyytti.
Se voi palvella sinua: Crucible for Crucible: Ominaisuudet, toiminnot, käytä esimerkkejä- Nämä metallit tarjoavat pinnan siten, että vety ja yhdiste reagoivat siten, että sidoksen taukot nopeutetaan.
- Ne vähentävät myös lajin leviämistilaa, mikä lisää tehokkaiden molekyylikokousten määrää. Ei vain, mutta jopa reaktio tapahtuu metallin huokosissa.
Katalyyttisen hydrauksen tyypit
Homogeeninen
Homogeenisesta katalyyttisestä hydrauksesta puhuu, kun reaktion väliaine koostuu yksivaiheesta. Tässä metallien käyttö puhtaissa valtioissaan, koska ne ovat liukenemattomia.
Sen sijaan käytetään näiden metallien organimetaalisia yhdisteitä, jotka ovat liukoisia ja niiden on osoitettu olevan korkeat saannot.
Yksi näistä organometallisista yhdisteistä on Wilkinson -katalyytti: triskloridi (trifenyylifiini) rodio, [(c6H5-A3P]3RHCL.
Nämä yhdisteet muodostavat kompleksin H: n kanssa2, aktivoida sen myöhemmälle lisäykselle Alkeeen tai Alquino.
Homogeeninen hydraus tarjoaa paljon enemmän vaihtoehtoja kuin heterogeeninen, koska kemia organometallisissa yhdisteissä on runsaasti: se riittää vaihtamaan metallia (PT, PD, RH, NI) ja ligandeja (orgaanisia tai epäorgaanisia molekyylejä, jotka on kytketty metallikeskukseen), toiseen Hanki uusi katalysaattori.
Heterogeeninen
Heterogeenisella katalyyttisellä hydrauksella, kuten juuri mainittiin, on kaksi vaihetta: yksi neste ja yksi kiinteä.
Metallikatalyyttien lisäksi on muitakin, jotka koostuvat kiinteästä seoksesta. Esimerkiksi Lindlar -katalyytti, joka koostuu platinasta, kalsiumkarbonaatista, lyijyasetaatista ja kinoliinista.
Lindlar -katalyyttillä on erityispiirteet, että se on huono alkeenien hydraamiseksi. Se on kuitenkin erittäin hyödyllinen osittaisille hydrauksille, ts. Se toimii erinomaisesti alkinissa:
Voi palvella sinua: lutecio: rakenne, ominaisuudet, käyttötarkoitukset, hankkiminenRc irticr + h2 => Rhc = chr
Mekanismi
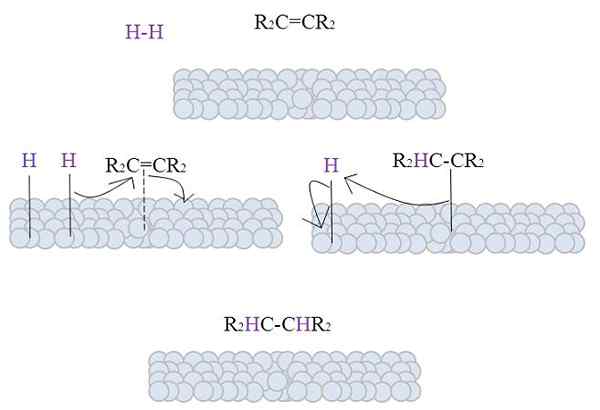
Kuva näyttää katalyyttisen hydrauksen mekanismin jauhettua metallia katalyyttinä.
Harmaat pallot vastaavat Platinumin sanoen metallipintaa. Molekyyli H2 (violetti väri) on lähellä metallin pintaa, samoin kuin korvaava Tetra Alkene, R2C = cr2.
H2 Vuorovaikutus metalliatomeja kulkevien elektronien kanssa ja H-M: n ajallisen linkin tauko ja muodostuminen tapahtuu, missä M on metalli. Tämä prosessi tunnetaan nimellä kemisorptio. Eli kemiallisten voimien adsorptio.
Alkeeeni on vuorovaikutuksessa samalla tavalla, mutta linkki muodostaa sen kaksoissidoksellaan (katkoviiva).
H-H-sidos on jo dissosioitunut ja jokainen vetyatomi pysyy kytkettynä metalliin. Samoin se tapahtuu organometallisissa katalyytit metallikeskuksissa, muodostaen H-M-H-välittäjäkompleksin.
Sitten se tapahtuu H: n siirtymisessä kohti kaksoissidosta, ja tämä avautuu muodostaen yhteyden metalliin. Sitten jäljellä oleva H liittyy toiseen hiileen alkuperäisestä kaksoissidoksesta, ja tuotettu alkaani lopulta vapautetaan, r2HC-CHR2.
Tämä mekanismi toistetaan niin monta kertaa kuin tarpeen, kunnes kaikki h2 olla täysin reagoinut.
Viitteet
- Carey, f. (2008). Orgaaninen kemia. MC Graw Hill.
- Shiver & Atkins (2008). Epäorgaaninen kemia. MC Graw Hill.
- Lew, J. (S.F.-A. Alkeenien katalyyttinen hydraus. Chem.Librettexts.org
- Mikä on katalyyttinen hydraus? - Mekanismi ja reaktio. Tutkimus toipunut.com

