Nikkelihydroksidi (III) rakenne, ominaisuudet, käytöt, riskit
- 1521
- 83
- Eddie Hackett
Hän Nikkelihydroksidi (III) Se on epäorgaaninen yhdiste, jossa nikkelimetallissa on hapettumismäärä 3+. Sen kemiallinen kaava on Ni (OH)3. Kuultujen lähteiden mukaan toistaiseksi ei ole ollut mahdollista tarkistaa nikkelihydroksidin (III) tai (OH) olemassaoloa3, Mutta nikkeliokso-hydroksidi (III), lapsi (OH) on saatu.
Nikkeli (III) NIO (OH) oksohydroksidi on musta kiteinen kiinteä aine, joka kiteytyy kahdella tavalla: beetamuoto ja gamma. Yleisin kiteinen muoto (OH) on beeta.
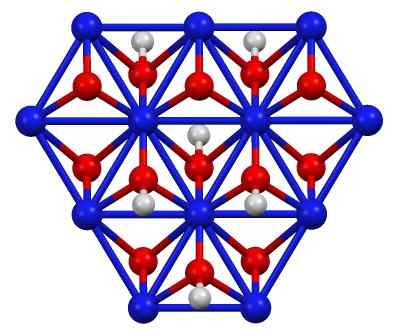
 Nikkelioksohydroksidirakenne (III), lapsi (OH). Sininen = nikkeli, punainen = happi, valkoinen = vety. Kirjoittaja: Smokefoot. Lähde: Oma työ. Lähde: Wikipedia Commons
Nikkelioksohydroksidirakenne (III), lapsi (OH). Sininen = nikkeli, punainen = happi, valkoinen = vety. Kirjoittaja: Smokefoot. Lähde: Oma työ. Lähde: Wikipedia Commons Lapsi (OH) voidaan saada hapettamalla nikkeli -nitraattiliuoksia (ii) (tai (ei3-A2) kloorilla (CL2) tai bromi (BR2) Kaliumhydroksidin (KOH) läsnä ollessa. Nikkeli (III) oksohydroksidi on hyvin liukoinen happoihin. Sillä on levitys nikkelistoissa, Supercassa.
Nikkeli (iii) Nio (OH) ja nikkelihydroksidi (II) tai (OH) (OH)2 Ne yhdistyvät useimpien sovellustensa toiminnassa, koska molemmat ovat osa samaa oksidin vähentämisyhtälöä.
Nikkeliyhdistelmänä lapsi (OH) aiheuttaa samat riskit muille nikkeläsuoloille, toisin sanoen ihon ärsytys tai dermatiitti ja syöpä.
[TOC]
Kiteinen rakenne
Nikkeli oksohydroksidi (III) kiteytyy kahdella tavalla: beeta ja gamma. Beeta-β-Nio (OH) -muodossa on hyvin samanlainen rakenne kuin β-NI (OH)2, mikä näyttää loogiselta, koska ensimmäinen tulee jälkimmäisen hapettumisesta.
Y-NIO (OH) -gammamuoto on nikkelihydroksidin (II) hapetustuote sen alfa-, a-ni (OH) -muodossa2. Jälkimmäisen tavoin gammalla on kerrosrakenne, jossa on alkalinen metalli -ionit, anionit ja vesi.
Elektroninen kokoonpano
Lapsessa (OH) nikkeli löytyy hapettumistilasta 3+, mikä tarkoittaa, että 3 elektronia puuttuu sen uloimmista kerroksista, ts. Kaksi kerroksen 4 elektronia 4 puuttuus ja elektroni kerroksesta 3d -d. Ni: n sähköinen kokoonpano3+ Lapsessa (OH) on: [ar] 3d -d7, Missä [ar] on jalo argonikaasun sähköinen kokoonpano.
Se voi palvella sinua: pi -linkkiNimikkeistö
- NIO (OH): Nikkelioksohydroksidi (III)
- Nikkelimusta
Ominaisuudet
Fyysinen tila
Musta kiteinen kiinteä.
Liukoisuus
NIO (OH) oksohydroksidi on hyvin liukoinen hapoihin. Gammafaasi liukenee rikkihapossa hapen evoluutiolla.
Muut ominaisuudet
Kuumassa vedessä siitä tulee nikkelin (II) ja (iii) oksohydroksidi, tai3JOMPIKUMPI2(VAI NIIN)4.
Se hajoaa 140 ºC: iin nikkeli (II) (lapsi- ja happioksidi.
Gammafaasi (γ-NIO (OH)) voidaan saada monella tavalla, esimerkiksi nikkeliä käsittelevä natriumperoksidin seoksella (Na NA2JOMPIKUMPI2) ja natriumhydroksidi (NaOH) lämpötilassa 600 ºC ja jäähdytys jäävedessä.
Gammavaihe hajoaa, kun se on lämmitetty 138 ºC: seen.
Sovellukset
Nikkeliakuissa
Edisonin nikkelihydrum-akku, jossa KOH: ta käytetään elektrolyyttinä, perustuu nikkeli-oksohydroksidireaktioon (III) raudan kanssa:
Ladata:
Fe + 2nio (OH) + H2Tai ⇔ usko (OH)2 + 2NI (OH)2
Taakka:
Se on palautuva oksidin vähentämisreaktio.
Näiden akkujen anodissa tapahtuu sarja kemiallisia ja sähkökemiallisia prosesseja. Alla on yleinen järjestelmä:
ladata
β-ni (OH)2 ⇔ β-nio (OH) + H+ + ja-
Taakka
Ikääntyminen ↑ ↓ ylikuormitus
ladata
α-ni (OH)2 ⇔ γ-nio (OH) + H+ + ja-
Taakka
Voi palvella sinua: arseeni: historia, rakenne, ominaisuudet, käyttötarkoituksetNikkeli -akkutekniikassa nikkelioksohydroksidi (III) NIO (OH) kutsutaan "nikkeli aktiivinen massa".
 Nikkelin ladattavat akut. Kirjoittaja: SuperUsergeneric. Lähde: Oma työ. Lähde: Wikipedia Commons.
Nikkelin ladattavat akut. Kirjoittaja: SuperUsergeneric. Lähde: Oma työ. Lähde: Wikipedia Commons. Elektrokatalyysissä uudistettavana katalyyttinä
Lapsia (OH) on käytetty menestyksekkäästi atsopiratsolien sähkösynteesissä aminopyratsolien sähkökataliittisen hapettumisen kautta. Sen hyödyllisyys alkoholista tai karbonyyliyhdisteistä alkavien karboksyylihappojen synteesissä on myös todistettu.
 Karboksyylihapon hankkiminen hapettamalla lapsi katalysoima alkoholi (OH). Lähde: Alun perin.Wikipedia. Alkuperäinen kirjoittajan lähettäjä oli V8RIK.Wikipedia. Lähde: Wikipedia Commons
Karboksyylihapon hankkiminen hapettamalla lapsi katalysoima alkoholi (OH). Lähde: Alun perin.Wikipedia. Alkuperäinen kirjoittajan lähettäjä oli V8RIK.Wikipedia. Lähde: Wikipedia Commons Toinen esimerkki on hydroksimetypyridiinin kvantitatiivinen muuntaminen pyridokarboksyylihapoksi. Tässä tapauksessa anodia vastaava teräs- tai nikkelielektrodi on peitetty lapsen kerroksella (OH). Väliaine, jossa elektrolyysi suoritetaan, on emäksinen.
Näissä reaktioissa lapsi (OH) toimii pelkistyskäyttäjänä tai ”redox” välittäjänä.
Elektrolyysi suoritetaan solussa, jossa on nikkeli -anodi ja titaanikatodi, alkaliväliaineessa. Prosessin aikana se on muodostettu tai (OH)2 Nikkelianodin pinnalla, joka hapetetaan nopeasti lapselle (OH):
Ni (OH)2 + vai niin- - ja- ⇔ Nio (OH) + H2JOMPIKUMPI
Lapsi (OH) reagoi orgaanisen substraatin kanssa ja haluttu orgaaninen tuote saadaan, uudistaen NI (OH)2-
NIO (OH) + orgaaninen yhdiste → Ni (OH)2 + tuote
Kun Ni (OH) uudistuu2, Katalyysireaktio jatkuu.
Lapsen (OH) käyttö sähkökatizerina mahdollistaa orgaanisten yhdisteiden hankkimisen alhaisista kustannuksista ja ympäristöystävällisellä tavalla.
Super CardPisors
Lapsi (OH) yhdessä Ni: n kanssa (OH)2 Ne muodostavat erinomaiset materiaalit ylimääräisille elektrodeille (englanti Superkapaasitot-A.
Ni (OH)2 + vai niin- ⇔ Nio (OH) + H2Tai + e-
Heillä on korkea kapasitanssi, edulliset kustannukset ja joidenkin viittausten mukaan ympäristövaikutukset.
 Lauhduttimet elektronisessa piirissä. Kirjoittaja: Pdphotos. Lähde: Pixabay.
Lauhduttimet elektronisessa piirissä. Kirjoittaja: Pdphotos. Lähde: Pixabay. Heillä on kuitenkin alhainen johtavuus. Tämä ratkaistaan mainittujen yhdisteiden nanohiukkasten avulla, koska siten lisää pinta -alaa ja vähentää diffuusioon tarvittavaa etäisyyttä, mikä varmistaa elektronien ja/tai ionien suuren nopeuden siirtymisen nopeuden.
Voi palvella sinua: elastiset materiaalitMetalli -ionien hapettumisessa
Yksi nikkelioksohydroksidin (III) kaupallisista sovelluksista perustuu sen kykyyn hapettaa koboltti -ionit (II) liuoksessa koboltti -ioneihin (III).
Riskejä
Liuoksessa nikkeli on vakaampi kuin ionia tai2+, Siksi ei ole tavallista olla yhteydessä ni3+. Varotoimenpiteet ovat kuitenkin samat, koska nikkeli, joko metallinen, liuoksessa tai sen kiinteiden suolojen muodossa, voi aiheuttaa ihon herkistämistä.
On suositeltavaa käyttää suojavarusteita ja vaatteita, kuten kasvojen suojaa, käsineitä ja turvakenkiä. Kaikkia tätä on käytettävä joka kerta, kun on mahdollisuus joutua kosketuksiin nikkeli ratkaisujen kanssa.
Jos dermatiittia esiintyy, sitä tulisi hoitaa lääkärin kanssa, jotta se johtuu nikkelistä.
Hengitysmahdollisuuksien suhteen se on hyvä käytäntö.
Kansainvälinen syöpätutkimusvirasto tai IARC luokitellaan kaikki nikkeliyhdisteet (lyhenne englanniksi Kansainvälinen syöpätutkimusvirasto), ihmisen karsinogeenien luokassa.
Tämä perustuu epidemiologisiin ja kokeellisiin tietoihin.
Viitteet
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Lyaliini, b.V. et al. Atsopyratsolien sähkösynteesi n-alkyyliaminopyratsolien hapettamalla lapsen (OH) anodissa vesipitoisessa alkal-A Green -menetelmässä N-N-homokouplelle. Tetrahedronkirjeet. 59 (2018) 2741-2744. ScienEdirect.com.
- Liuyang, Zhang, et ai. (2018). Nikkelipohjaiset materiaalit superkapaasitoille. Materiaalit tänään. ScienEdirect.com
- Ette, V.-Lla. ja mosolu, m. -Lla. (1977). Nikkeli mustan valmistelu. TAI.S. Patentti ei. 4 006 216. 1. helmikuuta 1977.
- Scharbert, b. (1993). Prosessi hydroksimetyylipyridiinijohdannaisten hapettamiseksi pyridiinikarboksyylihappojohdannaisille nikkelioksidihydroksidianodilla. TAI.S. Patentti ei. 5 259 933. 9. marraskuuta 1993.
- Kirk-Othmer (1994). Kemiallisen tekniikan tietosanakirja. Nide 17. Neljäs painos. John Wiley & Sons.
- Ullmannin teollisuuskemian tietosanakirja. (1990). Viides painos. Tilavuus 17. Vch verlagsgellschaft mbh.
- McBreen, James. (1997). Nikkelihydroksidit. Akkumateriaalien käsikirjassa. VCH -kustantaja. Ostista toipunut.Hallitus.
- « Macrocomputers -historia, ominaisuudet, käytöt, esimerkit
- Esitetyt analogiset tietokoneet, komponentit, tyypit »

