Natriumhydroksidi (NaOH) -rakenne, ominaisuudet, käytöt, synteesi

- 4266
- 603
- Edgar VonRueden
Hän natriumhydroksidia Se on epäorgaaninen yhdiste, jonka kemiallinen kaava on NaOH ja koostuu erittäin vahvasta metallipohjasta tai alkalista. 5 -prosenttisessa vedessä olevassa liuoksessa on pH lähes 14.
Se on erittäin hygroskooppinen valkoinen kiinteä aine ja se voi myös absorboida ilman hiilidioksidia natriumkarbonaatin muodostamiseksi. Kaupallisesti tulee muovipulloja, kuten pillereitä, joita ei voida paljastaa liian paljon aikaa ilmassa, eikä niitä pidä manipuloida spatuleilla.
 Natriumhydroksidipillerit kellolasilla. Lähde: Ei konetta luettavissa olevaa kirjailijaa. Walkerma oletti (tekijänoikeusvaatimusten perusteella). [Julkinen verkkotunnus]
Natriumhydroksidipillerit kellolasilla. Lähde: Ei konetta luettavissa olevaa kirjailijaa. Walkerma oletti (tekijänoikeusvaatimusten perusteella). [Julkinen verkkotunnus] Natriumhydroksidi voidaan syntetisoida reagoidessaan kalsiumhydroksidia natriumkarbonaatin kanssa. Tällä hetkellä se syntetisoidaan pohjimmiltaan suolaveden elektrolyysillä, ja se on kaasukloorituotannon toissijainen tuote.
Antaa. Sitä käytetään myös kodinpuhdistuksessa, vedenkäsittelyssä, alumiiniprosessoinnissa, lääketieteen valmistuksessa jne.; Ja ennen kaikkea se on toissijainen malli par excellence.
Natriumhydroksidi on erittäin syövyttäviä, kykenee aiheuttamaan ärsytystä ja ihon palovammoja ja silmiä. Pölyn hengittämällä se voi aiheuttaa keuhkojen turvotusta. Samaan aikaan sen nauttiminen voi aiheuttaa niin vakavia vammoja ruuansulatukselle, joka voi johtaa kuolemaan.
[TOC]
Rakenne
Vedetön
 NaOH -ionit. Lähde: Gabriel Bolívar.
NaOH -ionit. Lähde: Gabriel Bolívar. Ylivoimainen kuva näyttää ionit, jotka muodostavat NaOH: n. Napainen+ Sitä edustaa violetti pallo, kun taas hydroksyyli -anionin (hydroksidi tai oksidrili) OH- Punaisen ja valkoisen pallo. Molemmat Na -ionit+ ja oh- He ovat vuorovaikutuksessa vastakkaisten kuormituksensa sähköstaattisella vetovoimalla.
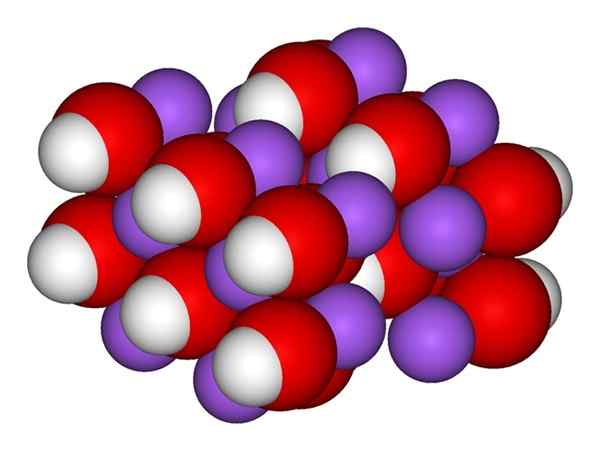 Natriumhydroksidirakenne
Natriumhydroksidirakenne Tällaiset vuorovaikutukset eivät ole suuntautuvia, joten ionisen NA: n nähtävyydet+vai niin- voi vaikuttaa muihin tietyllä etäisyydellä. Tuloksena on, että Na -ionit+ He hylkivät toisiaan, samalla tavalla kuin OH-, kunnes määritetään vähimmäis energiakite, jossa ne muodostavat järjestetyn ja jaksollisen rakenteen (kiteinen).
Siksi NAOH -anhydron ortorromiset kiteet (ilman vettä):
 Vedettömän natriumhydroksidin kiteisen rakenteen esitys. Lähde: Quibik Wikipedian kautta.
Vedettömän natriumhydroksidin kiteisen rakenteen esitys. Lähde: Quibik Wikipedian kautta. Ionit pysyvät riittävän yhtenäisinä, jotta NaOH: n vedettömälle kiteelle emäkseen 323 ºC (edellyttäen, että ympäristössä ei ole kosteutta).
Hydraatit
Molemmat NA+ Kuin oh- Ne ovat ioneja, jotka vesimolekyylit liuottan (hydraatti) helposti. Tämä suosii sen hydraatiota kiteidensä retikulaarisen energian yläpuolella, joten NaOH vapauttaa paljon energiaa, kun se joutuu kosketuksiin veden kanssa.
Se voi palvella sinua: Fehling -reaktio: valmistelut, aktiiviset edustajat, esimerkit, käyttöVedettömät kiteet voivat kuitenkin isännöidä vesimolekyylejä liukenematta; Eli natriumhydroksidi voi muodostaa lukuisia hydraatteja, NaOH · NH2JOMPIKUMPI. Vesimolekyyli voi hyvinkin muodostaa vety -sillan OH- (Hoh-Oh-) tai koordinoi NA: n kanssa+ (NA+-vai niin2-A.
NAOH: n ja H: n välisestä molaarisesta osuudesta riippuen2Tai monohydraatteja voi syntyä (NaOH · H2O), dihydraatit (NaOH · 2h2O), trihemakraatit (NaOH · 3.5H2O), tetrahydraatit (NaOH · 4H2O), heptahridaatit (NaOH · 7H2O) ja muut.
Jokainen nämä hydraatit voivat kiteyttää vesipitoisesta NaOH -liuoksesta, jolla on erilaiset massaprosentit ja eri lämpötiloissa. Tämän seurauksena NaOH: lla on monimutkainen veden liukoisuuskaavio.
Yleisesti ottaen hydraatit ovat vähemmän tiheitä ja niissä on alhaisemmat sulamispisteet. Tämä johtuu siitä, että vesimolekyylit "estävät" NA: n välistä vuorovaikutusta+ ja oh-, Dipolidipolivoimien lisääminen ionisten nähtävyyksien uhraamiseen.
Fysikaaliset ja kemialliset ominaisuudet
Nimeä
IUPAC Preferred Name: Natriumhydroksidi. Muut nimet: kaustinen sooda, ascarita (vähemmän yleinen)
Moolimassa
39 9971 g/mol
Ulkomuoto
Kiinteät tai valkoiset, seroosit tai läpinäkymättömät kiteet.
Sulamispiste
323 ºC
Kiehumispiste
1.388 ºC
Vesiliukoisuus
1.000 g/l lämpötilassa 25 ºC. Tämä osoittaa, kuinka paljon se voi liukentua veteen.
Sen vesipitoiset liuokset ovat viskoosisia, viskositeettiarvo on lähellä kahdeksankymmentä kertaa suurempi kuin vesi, ja vapauttavat hyvin lämpöä alussa. Jos sinulla on kosketus heidän kanssaan, he kääntävät liukas ihon ihon rasvahappojen saponifikaation vuoksi.
Perusteetti (PKB)
- 0,56
PHE
5 % P/P -liuoksella vedessä on pH lähes 14
Taitekerroin (ND)
Aallonpituudella 580,4 nm: 1 433 - 320 ºC ja 1 421 - 420 ° C.
Vakaus
Sitä sisältävät astiat on oltava tiukasti suljettuna natriumkarbonaatin muodostumisen estämiseksi. Tämä johtuu sen korkeasta hygroskooppisuudesta, mikä johtaa sen ympäristön kosteuden ja sen CO -CONTENT2.
Hajoaminen
Hajoamiseen kuumennettuna säteilee savun natriumoksidista.
Itsehuonekohta
Se ei ole syttyvä
Goo
4,0 CPOise nopeudella 350 ºC
Höyrystyslämpö
175 kJ/mol A 1.388 ºC
Pintajännitys
74,35 dynaa/cm 2,72 % P/P -liuoksessa vedessä 18 ° C: ssa.
Reaktiivisuus
Hapoilla
Reagoi orgaanisten ja epäorgaanisten mineraalihappojen kanssa aiheuttaen vettä ja vastaavaa suolaa. Rikkihapon tapauksessa reaktio on eksoterminen.
Voi palvella sinua: alumiinisulfidi (AL2S3): rakenne, ominaisuudet, käyttötarkoitukset2 naoh+h2Sw4 => Na2Sw4 + 2 h2JOMPIKUMPI
Happosioksidilla
Reagoi esimerkiksi rikkidioksidin kanssa, jolloin saadaan suola sulfiittia ja vettä:
2 NaOH +niin2 => Na2Sw3 + H2JOMPIKUMPI
Metallien kanssa
Sen vesipitoiset liuokset reagoivat joidenkin metallien kanssa aiheuttaen monimutkaisia natriumsuoloja. Esimerkiksi hänen reaktionsa sinkin kanssa aiheuttaa natrium sinkitin:
Zn + 2 NaOH + 2 H2O => na2[Zn (OH)4] + H2
Synteesi
Natriumhydroksidi syntetisoidaan pääasiassa kahdella menetelmällä: alun perin käytetyn natriumkarbonaatin käyttö ja natriumkloridielektrolyysi, tällä hetkellä suurempi teollisuuskäyttö.
Natriumkarbonaattireaktio ja kalsiumhydroksidi
Natriumkarbonaatti reagoi kalsiumhydroksidin kanssa prosessissa, joka tunnetaan nimellä Caustification:
CA (OH)2 + Naa2Yhteistyö3 => Caco3 + Naoh
Kalsiumkarbonaatti saostuu, jättäen natriumhydroksidin supernatantissa, joka konsentroituu haihduttamalla.
Natriumkarbonaatti on aiemmin peräisin Solvay -prosessista:
2 NaCl+ Caco3 => Na2Yhteistyö3 + Kacl2
Natriumkloridielektrolyysi
Natriumkloridielektrolyysi, läsnä suolavedessä, tuottaa vetykaasua, kloridikaasua ja natriumhydroksidia vesiliuoksessa:
2 NaCl+2 h2O => h2 + Cl2 + 2 NaOH
Elektrolyyttinen kammio koostuu osastosta, jossa anodi (+), titaanimetalli ja paikka, johon suolavesi sijoitetaan. Tämä osasto on erotettu katodilokerosta (-) huokoisella kalvolla.
Seuraava reaktio tapahtuu anodissa:
2 Cl- => Cl2 + 2 e- (hapetus)
Samaan aikaan tämä reaktio tapahtuu katodissa:
2 h2O +2 e- => H2 + vai niin- (Vähennys)
Natrium (na+) diffuusi anodilokerosta katodiin, ne erottavat ne, muodostaen natriumhydroksidin.
Sovellukset
Puhdistustuotteet
Natriumhydroksidia käytetään kotona käytettyjen saippuan ja pesuaineiden valmistukseen ja kaupallisessa toiminnassa. Natrium- ja kloorihydroksidin yhdistelmä tuottaa klooria valkaisuainetta, jota käytetään valkoisissa vaatteissa.
Se eliminoi myös rasvan kertymisen viemäriin, tuottaen sen eliminoinnin muuntamalla saippuiksi saponifikaatioprosessin kautta. Tämä mahdollistaa kotitalousputkien ja muiden rakennusten tukkeutumisen poistamisen.
Lääke- ja lääketieteelliset tuotteet
Natriumhydroksidia käytetään yleisten kipulääkkeiden, kuten aspiriinin, kehittämisessä. Myös lääkkeitä, joilla on antikoagulanttivaikutus, joka estää verihyytymien ja lääkkeiden muodostumisen hyperkolesterolemian vähentämiseksi.
Energiaprosessit
Natriumhydroksidia käytetään polttokennojen valmistuksessa, jotka toimivat paristoina sähkön tuottamiseksi moniin sovelluksiin, mukaan lukien kuljetus. Natriumhydroksidi -interventiolla valmistettua epoksihartsia käytetään tuuliturbiineissa.
Se voi palvella sinua: galvaaninen korroosio: mekanismit, esimerkit, suojausVedenkäsittely
Natriumhydroksidia käytetään veden happamuuden neutraloimiseen ja edistämään sen raskasmetallien eliminointia. Sitä käytetään myös natriumhypokloriittituotantoon, veden desinfiointiaineeseen.
Natriumhydroksidi reagoi alumiinisulfaatin kanssa alumiinihydroksidin muodostumiseksi: vesikäsittelylaitoksissa käytetty flokkulanttiaine hiukkasten sedimentaation lisäämiseksi, tuottaen sen selvennystä.
Paperinvalmistus
Natriumhydroksidia käytetään natriumsulfidin kanssa puun käsittelyssä selluloosan saamiseksi melkein puhtaalla tavalla, joka muodostaa paperin pohjan. Sitä käytetään myös paperin kierrätyksessä, koska musteen erottamisessa se antaa meille mahdollisuuden käyttää sitä uudelleen.
Teollisuusvalmistus
Natriumhydroksidia käytetään Rayónin, spandexin, räjähteiden, epoksihartsien, lasin ja keraamisen valmistuksessa. Sitä käytetään väriaineiden tekstiiliteollisuudessa ja prosessoivat puuvillakankaat.
Sokeriruokokäsittelylaitoksissa matalan lämpötilan natriumhydroksidia käytetään sokeriruo'on bagazo -tuotantoon.
Riskejä
Natriumhydroksidi on erittäin syövyttävä yhdiste, joten se voi aiheuttaa kosketuksella ihon, palovammojen, ampullisten ja jopa pysyvien arpien kanssa.
Kontaktissa silmiin se voi tuottaa vakavia palovammoja, turvotusta, kipua, hämärtyä näkö- ja vaikeissa tapauksissa se voi aiheuttaa pysyvän sokeuden.
Natriumhydroksidin nauttiminen voi aiheuttaa palovammoja huulille, kielelle, kurkkuun, ruokatorveen ja vatsaan. Tavallisten oireiden joukossa ilmenee pahoinvointia, oksentelua, vatsakouristuksia ja ripulia.
Vaikka natriumhydroksidin hengitys on harvinaista, ja voi tapahtua vain yhdistepölyn läsnäolosta ilmassa tai sitä sisältävän kasteen muodostumisen vuoksi, se aiheuttaa ärsytyksen keuhkoissa.
Kroonisen altistumisen tapauksessa tämä voi aiheuttaa keuhkojen turvotusta ja vakavaa hengitysvaihetta, joka muodostaa lääketieteellisen hätätilanteen.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). Hydroksidi -natrium. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2019). Hydroksidi -natrium. Pubchem -tietokanta. CID = 14798. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Amerikkalaiset elementit. (2019). Natriumhydroksidiliuos. Haettu: Amerikkalaiset.com
- Kemialliset turvallisuustiedot. (2019). Hydroksidi -natrium. Talteenotettu: ChemicalSafetyfaktit.org
- NJ Health. (2015). Hydroksidi -natrium. [PDF]. Palautettu: NJ.Hallitus
- Kanadan työterveys- ja turvallisuuskeskus. (2019). Osh vastaa tosiasioihin: natriumhydroksidi. Toipunut: COHS.Ac
- Ausetetute. (S.F.-A. Natriumhydroksidi ja kloorin tuotanto elektrolyysillä. Palautettu: ausetetute.com.Au
- « Chol -kielen alkuperä, ominaisuudet, missä puhut, sanat
- Indeksoidut aikakauslehtien ominaisuudet, kriteerit, vaikutusvaltaiset esimerkit »

