Fysiikan ja kemian käsitteen ionisaatio, prosessi ja esimerkit

- 4801
- 77
- Alonzo Kirlin
Se ionisaatio Se on kaikki prosessi, jossa sähkökuormat generoidaan neutraalista hiukkasista. Tämä voi tapahtua erilaisten luonnollisten mekanismien tai voimien kautta joko säteilyllä, lämmöllä, sähkökenttillä, magneettikentällä tai kemiallisilla reaktioilla. Ionit tuotetaan seurauksena, jotka ovat positiivisesti tai negatiivisesti ladattuja atomeja.
Ionisaatio on fysikaalisten, kemiallisten tai luonnonilmiöiden sinfiinien perustavanlaatuinen prosessi, jälkimmäinen on monta kertaa fysikaalis -kemiallisten muutosten seos. Esimerkiksi fysikaalisissa ionisoinnissa periaatteessa kemiallisia reaktioita ei tapahdu; Eli ionin tuotanto ei tarkoita uusien linkkien hajoamista tai muodostumista.
 Monet luonnonilmiöt, kuten pohjoisvalot, perustuvat ilmakehän molekyylien ionisointiin. Lähde: Pixabay.
Monet luonnonilmiöt, kuten pohjoisvalot, perustuvat ilmakehän molekyylien ionisointiin. Lähde: Pixabay. Luonnollisissa ilmiöissä tähän ionisointiin liittyy kuitenkin yleensä kemiallisia reaktioita, kuten otsonin muodostumista matalalla korkeudella. Myös ukonilman aikana syntyy typpioksideja säteiden ja niiden voimakkaiden lämpötilojen takia, jotka hapettavat ilman typen.
Toisaalta ionisaatio voi hiipiä: samassa vedessä, kahden pinnan välisessä hankauksessa, metallien hapettumisissa tai tiettyjen kaasujen liukenemisessa vedessä.
[TOC]
Kemian ionisaatio
Hapettumisen vähentäminen
 Lelun paristojen aikana ionit ja elektronit ovat jatkuvasti. Lähde: D J Shin/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0)
Lelun paristojen aikana ionit ja elektronit ovat jatkuvasti. Lähde: D J Shin/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0) Kemiallisessa ionisaatiossa ionit tuotetaan murtamalla tai linkkien muodostumisella. Kaksi ainetta ansaitsevat tai menettävät elektronit peruuttamattomasti: elektronit menettävät positiivisen kuorman, kun taas se, joka voittaa, säilyttää negatiivisen kuorman.
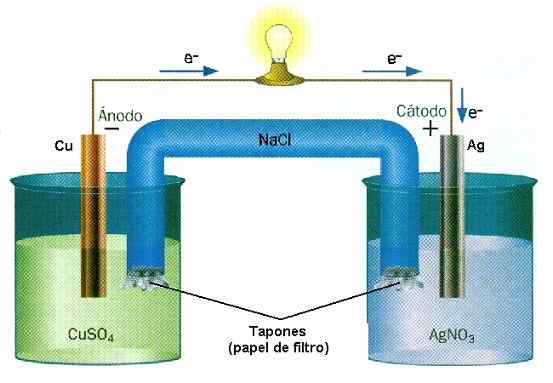
 Esimerkki oksidireaktion vähenemisestä Cu-Ag-kasaan. Lähde: Vesiseinä/CC BY-SA (http: // creativecommons.Org/lisenssit/by-SA/3.0/)
Esimerkki oksidireaktion vähenemisestä Cu-Ag-kasaan. Lähde: Vesiseinä/CC BY-SA (http: // creativecommons.Org/lisenssit/by-SA/3.0/) Paristoissa aine menettää elektroneja, kun taas toinen voittaa ne. Nämä elektronit kulkevat ja aktivoivat laitteen sähköpiirit lopulta palaamaan toiseen paaluosastoon, jossa toinen aine odottaa niitä kiinni ja lataamaan negatiivisesti. Tämä on esimerkki kemiallisesta ionisaatiosta, joka suoritetaan oksidin vähentämisreaktiolla.
Voi palvella sinua: glukonihappo: rakenne, ominaisuudet, synteesi, käyttöHeterolyyttinen repeämä
Toinen kemiallisen ionisaation tyyppi johtuu heteroliittisesta repeämästä. Kun tämä tauko tapahtuu, A-B-linkki on rikki ionien muodostamiseksi+ ja b-, Koska elektronit on suunnattu siihen atomiin, jolle he "tuntevat" suuremman affiniteetin. Heteroliittinen repeämä on yleensä ensimmäinen askel, joka ohjaa monien orgaanisten reaktioiden mekanismeja.
Itsemääritelmä
Sähkökuormat eivät vain näytä elektronien liikettä sinänsä, vaan myös rikkoutuneiden linkkien kautta, jotka ovat atomien vaihdossa. Näin on itsehallinta, joka tapahtuu saman yhdisteen kahden molekyylin välillä.
Kaikista kemiallisista ionisoinneista itsesyistys on yksinkertaisin ja huomaamaton, koska sillä ei ole kykyä suorittaa sähkövirtaa itsessään.
Ionisaatio fysiikassa
Staattinen sähkö
 Tämän tytön hiukset veloittavat positiivisesti ja hylkäävät toisiaan staattisen sähkön takia. Lähde: Biseup Ganguly/CC by (https: // creativecommons.Org/lisenssit/by/3.0)
Tämän tytön hiukset veloittavat positiivisesti ja hylkäävät toisiaan staattisen sähkön takia. Lähde: Biseup Ganguly/CC by (https: // creativecommons.Org/lisenssit/by/3.0) Ionisaatiolla on myös paljon osallistumista fyysisiin ilmiöihin. Fysiikan ionisaatio ei yleensä tarkoita kemiallisia reaktioita. Aineen atomit ladataan sähköisesti menettämättä alkuperäistä henkilöllisyyttään.
Pinnat voivat vaihtaa elektroneja, kun ne hierovat, jos joku niistä on tehokkaampi niiden varastoinnissa, mikä johtaa staattiseen sähköön. Atomista ei enää puhu, vaan koko materiaalista, joka saa negatiivisen tai positiivisen kuorman, ja että kun tasapaino palautetaan, sähköiski voi kirjaimellisesti tuottaa kahden materiaalin tai rungon välillä.
Kaasumainen ionisaatio
Dispergoituneet kaasumaiset atomit voivat menettää elektroneja, jos niihin kohdistuu sähkökenttä. Näin tekemällä atomit ovat innostuneita ja vapauttaneet elektroneja. Sitten jäähdytettäessä ja palattuaan heidän asemaansa pienenä energiana, fotonit sanovat hyvästit. Ja prosessi toistetaan uudestaan ja uudestaan. Tulos: valaistuksen tai sähkön lähde.
Voi palvella sinua: boorioksidi (B2O3): Mikä on, rakenne, ominaisuudet, käyttöSäteily tai törmäys ionisaatio
Samoin aine voi saada energiaa, jonka tarjoaa erityyppiset säteilyt (gamma, x -säteily, ultravioletti jne.) tai törmäämällä korkean energian hiukkasten kanssa (alfas, betat ja neutronit).
Energia vaikutti on sellainen, että atomin elektroni on välitön. Tämäntyyppinen ionisaatio liittyy useisiin radioaktiivisiin ja kosmisiin ilmiöihin.
Vesi -ionisaatio
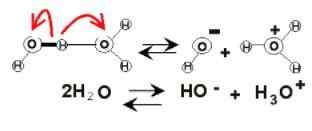 Veden dissosiaatio
Veden dissosiaatio Veden rintakehässä sähkövaraukset voivat ilmetä sen ionisaation takia. Tämä on kemikaalia, koska kaksi vesimolekyyliä reagoi yhtäkkiä toisiinsa dissosioitumaan ja tuottamaan H -ionit3JOMPIKUMPI+ ja oh--
2H2Tai (l) ⇌ h3JOMPIKUMPI+(AC) + OH-(AC)
Tämä tasapaino on joutunut hyvin siirtymään veteen, joten näitä ioneja on tuskin halveksittava määrä.
Ilma -ionisaatio
Ilmamolekyylit eivät osallistu mihinkään itsekasian tasapainoon. Happi, typpi, argoni, vesihöyry ja muut ilman muodostavat kaasut, eivät vaihda atomeja tai elektroneja. Siksi ilma ei ole hyvä sähköjohdin normaaleissa olosuhteissa.
Kuitenkin, jos siihen kohdistuu sähkökenttä, säteily tai voimakas lämpötila, se voi olla ioni ja tulla hyväksi kuljettajaksi. Näin tapahtuu esimerkiksi, kun sähkösäteet putoavat pilvistä maahan, kulkevat elektronit ilman läpi äkillisellä valon räjähdyksellä.
Ionisaatioesimerkit
Edellisissä osissa on nimitetty joitain ionisaatioesimerkkejä. Lopuksi jotkut muut mainitaan.
Metallin hapettuminen
Kun metallit hapettuu joko maapallon hapen vaikutuksella tai happamien aineiden hyökkäyksellä, ne saavat positiivisia varauksia oksidien tai suolojen muodostamiseksi, vastaavasti.
Voi palvella sinua: kemiallinen prosessi: periaatteet, tyypit, esimerkitEsimerkiksi rauta on ionisoitu hapen ansiosta muuttua usko -ioneiksi3+, Sijaitsee rautaoksidikiteissä. Magnesium toisaalta liukenee rikkihappoa kadottamaan elektroneja ja pysymään Mg -ioneina2+ Magnesiumsulfaattisuolassa.
Kaasun liukeneminen veteen
Jotkut kaasut, kuten ammoniakki ja vetykloridi, liukenevat veteen menettämään neutraalisuutensa ja aiheuttavat ionin muodostumista. Esimerkiksi ammoniakki, kun se liukenee osittain vapauttaa NH -ionit4+ ja oh-. Samaan aikaan vetykloridi liukeneessa tuottaa H -ionit3JOMPIKUMPI+ ja cl- täysin.
Samanlainen tapaus on suolojen liukeneminen veteen, kuten magnesiumsulfaatti, MGSO4. Kuitenkin Mg -ionit2+ Ja niin42- Ne ovat jo läsnä suolakiteissä ennen liukenemista veteen.
Valaistuslamput tai putket

Höyryvalaisimissa tai valaistusputkissa kaasumaiset atomit, joissa on sähköiskuja, ovat innostuneita tuottamaan tietyn määrän valoa ja värejä. Esimerkiksi tämä ionisaatio tapahtuu natrium- tai elohopeavalaisimissa, samoin kuin kuuluisissa neonvaloissa, joissa on kirkkaat värit ravintolassa tai myymälöissä.
Ionisaatioenergiat
Ionisaatioenergiaa, jaksollista ominaisuutta, tutkitaan kemiallisten elementtien karakterisoimiseksi sen helppouden mukaan, jolla niiden kaasumaiset atomit luovuttavat elektronit positiivisesti kuormitukseen. Siten esimerkiksi metalleilla on yleensä alhaisimmat ionisaatioenergiat, kun taas ei -metalliset elementit ja jalokaasut, korkeimmat.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Serway, R., Jewett, J. (2008). Fysiikka tieteen ja tekniikan fysiikka. Osa 1. Seitsemäs. Painos. Meksiko. Cengage Learning Editors.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2020). Ionisaatio. Haettu: vuonna.Wikipedia.org
- Enyclopaedia Britannica -toimittajat. (17. lokakuuta 2016). Ionisaatio. Encyclopædia britannica. Toipunut: Britannica.com
- Doug Stewart. (2018). Ionisaation määritelmä: mikä on ionisaatio? Toipunut: Chemicool.com
- John Zavisa. (1. huhtikuuta 2020). Kuinka salama toimii. Toipunut: Tiede.Howstuffwork.com
- « 18 käyttäytymistyyppiä ja niiden ominaisuuksia (esimerkkejä)
- Keltainen liberalismi alkuperä, ominaispiirteet, syyt, seuraukset »

