Laminiinin ominaisuudet, rakenne, toiminnot, tyypit
- 3419
- 1026
- Joshua Emmerich
Se Laminiini Se on yksi proteiineista, jotka muodostavat selkärankaisten epiteelikudoksen peruskalvon solunulkoisen matriisin. Tämäntyyppinen proteiini tarjoaa sitoutumistuen konjunktiivisten kudossolujen välillä, joten ne toimivat näiden koheesiossa ja tiivistämisessä.
Yleensä laminiinit ovat vastuussa monimutkaisen proteiiniverkon tilaamisesta, joka muodostaa solunulkoisen matriisin tai peruskudoksen kalvon. Tyypillisesti laminiinit liittyvät proteiineihin, kuten kollageeni, proteoglykaanit, entaktiinit ja hepar -sulfaatti.
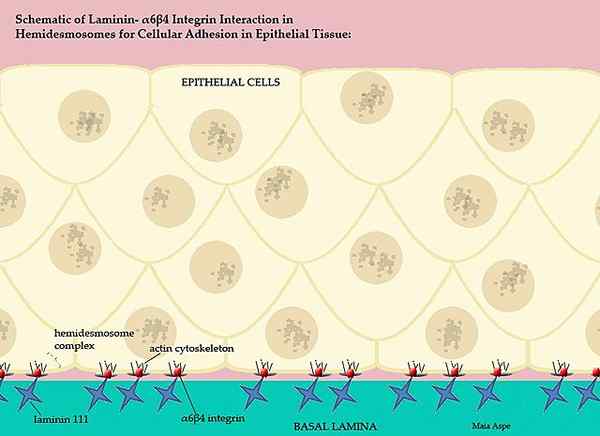
 Laminiinit ja niiden osallistuminen selkärankaisten kalvoon (lähde: maiape/cc by-s (https: // creativecommons.Org/lisenssit/by-SA/3.0) Wikimedia Commonsin kautta)
Laminiinit ja niiden osallistuminen selkärankaisten kalvoon (lähde: maiape/cc by-s (https: // creativecommons.Org/lisenssit/by-SA/3.0) Wikimedia Commonsin kautta) Tämä monimutkainen peruskalvo, jonka laminiinit tilaavat, erottaa kudosten epiteeliset osat, toisin sanoen jokainen solunulkoinen matriisi erottaa endoteelin mesototiosta ja mesoteliton solunulkoinen matriisi erottaa tämän kerroksen epiteelistä.
Monet tutkimukset ovat osoittaneet, että mutatoituneiden laminiinigeenien ekspressio on potentiaalisesti tappava solulle, koska nämä ovat myös vastuussa melkein kaikkien peruskalvossa tapahtuvien monimutkaisten vuorovaikutusten säätelystä.
Kaikissa selkärankaisissa on paljon laminiinien perheitä. Ne vaihtelevat koostumuksen, muodon, toiminnan ja alkuperän suhteen. Samassa yksilössä eri kudoksissa löytyy erilaisia laminiineja, jotka kukin on sopeutunut sitä ilmentävän kudoksen ympäristöön.
[TOC]
Laminiiniominaisuudet
Laminiinimonomeerit tai yksiköt koostuvat erilaisista glykoproteiiniketjuista heterotromeeristä. Nämä proteiinit sisältävät monia erilaisia domeeneja (monidominiumit) ja ovat olennainen osa kudosten varhaisen alkion kehitystä.
Laminiinien yleinen muoto on eräänlainen "risti" tai "Y", vaikka joillakin on pitkä baarimuoto neljällä seurauksella. Tämä pieni variaatio mahdollistaa jokaisen laminiinityypin säännöllisen riittävän integroinnin mistä tahansa kudoksen sijainnista.
Se voi palvella sinua: P-nitrofenoli: Ominaisuudet, käytöt ja toksisuusLaminiinilla on korkea molekyylipaino, joka voi vaihdella laminiinityypistä riippuen 140 - 1000 kDa.
Yleensä jokaisessa peruskalvossa on yksi tai useita erityyppisiä laminiineja ja jotkut tutkijat ehdottavat, että laminiinit määrittävät suuren osan kudoksen peruskalvojen fysiologisesta toiminnasta, jossa niitä löytyy.
Selkärankaisten eläimissä on löydetty ainakin 15 erityyppistä laminiinia, jotka on luokiteltu perheeseen, koska ne muodostetaan samasta trimmeristä, mutta erilaisilla yhdistelmillä. Selkärangattomista eläimistä he ovat löytäneet välillä 1 - 2 erilaista trimeeriä.
Nykyiset tutkimukset viittaavat siihen, että kaikkien selkärankaisten eläinten laminiinit syntyivät ortologien erilaistumisen kautta, toisin sanoen kaikilla geeneillä, jotka koodaavat laminiineille.
Rakenne
Huolimatta suuresta määrästä funktioita, jotka säätelevät laminiineja, niillä on melko yksinkertainen rakenne, joka on suurimmaksi osaksi säilynyt tiedossa olevien eri tyyppien joukossa.
Jokainen laminiini koostuu kolmesta erilaisesta ketjusta, jotka on kietoutunut toisiinsa, muodostaen eräänlaisen "kietoutuneen kuidun". Jokainen kolmesta ketjusta tunnistetaan Alfa (α), beeta (β) ja gamma (y).
Kunkin laminiinin trimmerin muodostuminen riippuu kunkin sen ketjun C-terminaalisen alueen liitosta. Kunkin molekyylin sisällä nämä ketjut pariksi on peptidilinkkien ja kolmen disulfidisilran kautta, jotka antavat rakenteelle suuren mekaanisen resistenssin.
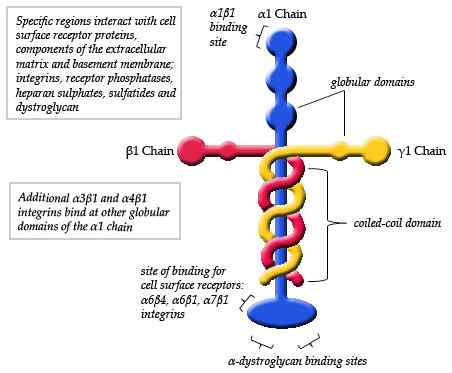 Kaavio kaavio laminiinin rakenteesta (lähde: maiape/cc by-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0) Wikimedia Commonsin kautta)
Kaavio kaavio laminiinin rakenteesta (lähde: maiape/cc by-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0) Wikimedia Commonsin kautta) Tyypillisten laminiinimonomeerien elektronisella mikroskopialla tehdyt havainnot ovat yksityiskohtaisesti esittäneet, että rakenne on eräänlainen epäsymmetrinen risti, jonka pitkä käsivarsi on noin 77 nm (nanometrit), jolle on ominaista näkyvä globaali muoto yhdessä päissä.
Voi palvella sinua: väestödynamiikkaLisäksi havaitaan kolme lyhyttä vartta, kaksi noin 34 nm: stä ja yksi noin 48 nm: stä. Jokainen käsivarsi päättyy yhdellä palloisella päähän, samanlainen kuin pääketju, mutta pienempi.
Ero erityyppisten laminiinien välillä johtuu pääasiassa a -ketjujen eroista, jotka voidaan taittaa ainakin kolmella eri tavalla; Vaikka tällä hetkellä kaikkien ketjujen muunnelmat on tunnistettu:
- 5 erilaista laminiini -ketjua α
- 3 β -ketjujen variaatiota
- 3 γ -ketjujen variaatiota
Funktiot
Laminiinien tärkein ja yleisesti tutkittu toiminta on vuorovaikutus reseptoreiden kanssa, jotka ovat ankkuroituneet solukalvojen vieressä olevien solujen solukalvoihin, joissa näitä löytyy.
Tämä vuorovaikutus saa nämä proteiinit osallistumaan useiden solujen aktiivisuuksien ja signalointireittien säätelyyn. On määrä mainita, että niiden toiminnot riippuvat niiden vuorovaikutuksesta solun pinnalla olevien spesifisten reseptoreiden kanssa (monet kalvoreseptoreista luokitellaan parhaillaan kyvynsä mukaan liittää laminiineja).
Integriinit ovat reseptoreita, jotka ovat vuorovaikutuksessa "ei -integriinin" laminiinien ja reseptoreiden kanssa, joilla ei ole kykyä liittyä näihin proteiineihin. Suurin osa "ei -integriinireseptoreista" on proteoglykaania, jotkut dystroglykaanit tai syndecanos.
Kehon elimien kudosten kypsyminen tapahtuu varhaisten laminiinien korvaamisella, jotka alun perin sijoitettiin nuorten elimien muodostavien kudosten peruskalvoon.
Laminiinien sisällä eniten tutkittu tyyppi on laminiini-1, joka liittyy suoraan minkä tahansa tyyppisen neuronin aksonien kasvuun olosuhteissa In vitro, Koska ne säätelevät "kasvukartion" liikkumista neuronien pinnalla.
Voi palvella sinua: Urea -liemi: Mikä on, perusta, valmistelu, käyttöNimikkeistö ja tyypit
Biokemistit pitävät laminiinien perhettä erittäin suurena proteiiniperheenä, joista harvat sen jäsenistä ovat edelleen tiedossa. Nykyaikaiset työkalut sallivat kuitenkin uuden tyyppiset laminiinit vilkaisemaan.
Tällaiset proteiinit tunnistetaan jokaisella numerolla, alkaen yhdellä numerolla 15 (laminiini-1, laminiini-2 ... laminiini-15).
Käytetään myös toista nimikkeistöä, joka osoittaa, minkä tyyppistä ketjua jokaisella laminiinilla. Esimerkiksi laminiini -11 koostuu alfa (α) -5 -ketjusta, beetaketjulla (β) -2 ja gammaketjulla (γ) -1, joten se voidaan nimetä laminina -521.
Lisäksi jokainen laminiini luokitellaan sen toiminnan mukaan, johon se liittyy, ja myös sen erityisen kehon kudoksen mukaan, johon se osallistuu. Joitakin esimerkkejä laminiineista ovat:
- Lamina-1: joka osallistuu epiteelikehitykseen
- Laminina-2: Osallistunut kaikkien kudosten, perifeerisen hermoston ja glomerulus-matriisin myogeeniseen kehitykseen.
- Lamina-3: Osallistu nivelyhteisöihin
- Lamina-4: Toimii neuromuskulaarisissa ammattiliittoissa ja glomerulien mesangiaalimatriisissa
- Laminina-5, 6 ja 7: Ne toimivat mieluiten epidermaalikudoksissa.
Viitteet
- Miner, J. H., & Yurchenco, P. D -d. (2004). Laminiini toimii kudoksen morfogeneesissä. Annu. Rev. Solujen kehitys. Bioli., 20, 255-284.
- Rasmussen, D. G. K -k -., & Karsdal, M. -Lla. (2016). Laminiinit. Kollageenien, laminiinien ja elastiinin biokemiassa (PP. 163-196). Akateeminen lehdistö.
- Sasaki, t., Fässler, r., & Hohenester, ja. (2004). Laminiini: Kohdekalvokokoonpanon ydin. The Journal of Cell Biology, 164 (7), 959-963.
- Timpl, r., Engel, J., & Martin, G. R -. (1983). Monitoiminen laminiini-A-proteiini kellarikalvojen. Biokemiallisten tieteiden trendit, 8 (6), 207-209.
- Timpl, r., Rohde, h., Robey, P. G., Rennard, S. Yllyttää., Foidart, j. M., & Martin, G. R -. (1979). Laminiini-A-glykoproteiini kellarikalvoista. Journal of Biological Chemistry, 254 (19), 9933-9937.
- Tryggvason, k. (1993). Laminiiniperhe. Nykyinen mielipide solubiologiassa, 5 (5), 877-882.

