Charles Law -kaavat ja yksiköt, kokeilu, harjoitukset

- 3677
- 106
- Alonzo Kirlin
Se Charles Law tai Guy-Lussac on sellainen, joka sallii kaasumaisen tilan yhden ominaisuuden lausunnon: kaasun miehittämä tilavuus on suoraan verrannollinen lämpötilaan vakiopaineessa.
Tämä suhteellisuus on lineaarinen kaikilla lämpötiloissa, jos kyseinen kaasu on ihanteellinen; Kuninkaalliset kaasut toisaalta poikkeavat lineaarisesta suuntauksesta niiden tiivistymispisteen lähellä sijaitsevissa lämpötiloissa. Tämä ei kuitenkaan ole rajoittanut tämän lain käyttöä loputtomiin sovelluksiin, joihin kaasut osallistuvat.
 Kiinalaiset lyhdyt tai toiveet. Lähde: Pxhere.
Kiinalaiset lyhdyt tai toiveet. Lähde: Pxhere. Yksi Charlesin lain parin huippuosaamisesta on läsnäolo aerodynaamisissa ilmapalloissa. Muita yksinkertaisempia ilmapalloja, kuten toiveita, kutsutaan myös kiinalaisiksi lampuiksi.
Miksi jatkuva paine? Koska jos paine nousee, se tarkoittaisi, että säiliö, jossa kaasu sijaitsee, on tiukasti suljettu; Ja tämän kanssa kaasumaisten hiukkasten törmäykset tai vaikutukset mainittua säiliön sisäistä seiniä vastaan (Boyle-Maleotte -laki) lisäävät sisäisten hiukkasten törmäyksiä tai vaikutuksia (Boyle-Maleotte Law).
Siksi kaasun käyttämässä määrässä ei tapahdu muutosta, ja Charlesin laki ei olisi tiukasti. Vastoin hermeettistä astiaa, toiveiden ilmapallojen kudos edustaa liikkuvaa estettä, joka pystyy laajentumaan tai supistumaan sisäpuolella olevan kaasun aiheuttamasta paineesta riippuen riippuen paineesta.
Kuitenkin, kun ilmapallokudos laajenee, kaasun sisäinen paine pysyy vakiona, koska se lisää aluetta, jolla sen hiukkaset törmäävät. Mitä korkeampi kaasun lämpötila, sitä suurempi hiukkasten kineettinen energia ja siten törmäyksien lukumäärä.
Ja kun maapallo laajenee uudelleen, törmäykset sen sisäseiniä vastaan pysyvät vakiona (ihannetapauksessa).
Joten mitä kuumempi kaasu on, sitä suurempi maapallon laajentuminen ja sitä enemmän se nousee. Tulos: Punertavan (vaikka vaaralliset) valot on ripustettu taivaalla yötä joulukuun aikana.
[TOC]
Mikä on Charlesin laki?
Lausunto
Ns. Charles Law tai Gay-Lussacin laki selittää riippuvuuden, joka on olemassa kaasun käyttämän määrän ja sen absoluuttisen lämpötilan tai Kelvinin lämpötilan arvon välillä.
Laki voidaan ilmaista seuraavasti: Jos paine pysyy vakiona, on täytetty, että ”kaasun tietylle massalle se lisää sen tilavuutta 1/273 kertaa suunnilleen sen tilavuuteen 0 ºC: iin, jokaiselle asteelle (1 ºC ) se lisää sen lämpötilaa ".
Työpaikka
Lain laatimisen sallitut tutkimukset aloittivat Jacques Alexander Cesar Charles (1746-1823) 1780-luvulla (1746-1823). Charles ei kuitenkaan julkaissut tutkimuksensa tuloksia.
Myöhemmin John Dalton vuonna 1801 onnistui kokeellisesti määrittämään, että kaikki hänen tutkitut kaasut ja höyryt laajenevat kahden määritetyn lämpötilan välillä samassa tilavuudessa. Gay-Lussac vahvisti nämä tulokset vuonna 1802.
Charlesin, Daltonin ja Gay-Lussacin tutkimustyöt saivat selvittää, että kaasun ja sen absoluuttisen lämpötilan käyttämä tilavuus ovat suoraan verrannollisia. Siksi lämpötilan ja kaasun tilavuuden välillä on lineaarinen suhde.
Se voi palvella sinua: Heterogeenisten seosten erottamismenetelmätKaavio
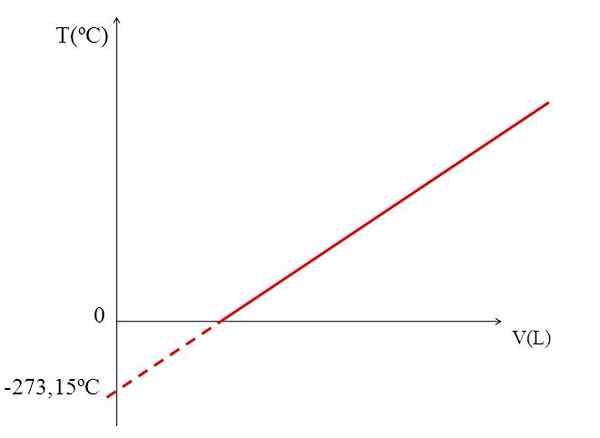 T VS V -kaavio ihanteelliselle kaasulle. Lähde: Gabriel Bolívar.
T VS V -kaavio ihanteelliselle kaasulle. Lähde: Gabriel Bolívar. Kaavion (ylemmän kuvan) toteuttaminen kaasun tilavuudesta lämpötilaa vasten tuottaa suoran linjan. Linjan leikkaus X: n akselin kanssa, 0 ºC lämpötilassa, mahdollistaa kaasun tilavuuden 0 ºC: n akselin saamisen.
Samoin linjan leikkaus X: n akselin kanssa antaisi tietoja lämpötilasta, jolle kaasun käyttämä tilavuus olisi nolla "0". Dalton arvioi tämän arvon lämpötilassa -266 ºC, lähellä Kelvinin ehdottamaa absoluuttista (0) absoluuttista arvoa.
Kelvin ehdotti lämpötila -asteikkoa, jonka nollan tulisi olla lämpötila, jossa täydellisellä kaasulla olisi nolla tilavuus. Mutta näissä alhaisissa lämpötiloissa kaasut nesteytetään.
Siksi emme voi puhua kaasujen määristä sellaisenaan, että absoluuttisen nollan arvon tulisi olla -273,15 ºC.
Kaavat ja mittausyksiköt
Kaavat
Charlesin laki nykyaikaisessa versiossa osoittaa, että kaasun tilavuus ja lämpötila ovat suoraan verrannollinen.
Niin:
V / t = k
V = kaasun tilavuus. T = Kelvinin lämpötila (k). K = suhteellisuusvakio.
Volyymi V1 ja lämpötila t1
k = v1 / T1
Myös volyymi V2 ja lämpötila t2
k = v2 / T2
Sitten vastaavat kahden yhtälöä K -yhtälölle
V1 / T1 = V2 / T2
Tämä kaava voidaan kirjoittaa seuraavasti:
V1 · T2 = V2 · T1
Puhdistus v2, Kaava saadaan:
V2 = V1 · T2 / T1
Yksiköt
Kaasun tilavuus voidaan ilmaista litrana tai missä tahansa sen johdetussa yksikössä. Samoin tilavuus voidaan ilmaista kuutiometreinä tai missä tahansa johdetussa yksikössä. Lämpötila on ilmaista absoluuttisessa lämpötilassa tai Kelvin -lämpötilassa.
Joten, jos kaasun lämpötilat ilmaistaan Celsius- tai Celsius -asteikolla, niiden kanssa laskelman suorittamiseksi, lämpötilaan tulisi lisätä 273,15 ºC: n määrä, jotta ne voidaan viedä absoluuttisiin lämpötiloihin tai Kelviniin.
Jos lämpötilat ilmaistaan Farenheit -asteina, se tulisi lisätä näihin lämpötiloihin 459,67 ºR, jotta ne saattaisi.
Toinen tunnettu Charlesin lain kaava, joka liittyy suoraan sen lausuntoon, on seuraava:
Vt = Vjompikumpi (1 + T/273)
Missä vt Se on kaasun miehittämä tilavuus tietyssä lämpötilassa, ilmaistuna litrana, cm3, jne.; ja vjompikumpi Se on kaasun miehittämä tilavuus 0 ºC: n nopeudella. Sen puolestaan T on lämpötila, jossa tilavuuden mittaus tehdään, ilmaistuna celsius (ºC) asteina (ºC).
Ja lopuksi, 273 edustaa absoluuttista nollaarvoa Kelvinin lämpötila -asteikolla.
Kokeilu lain osoittamiseksi
Asennus
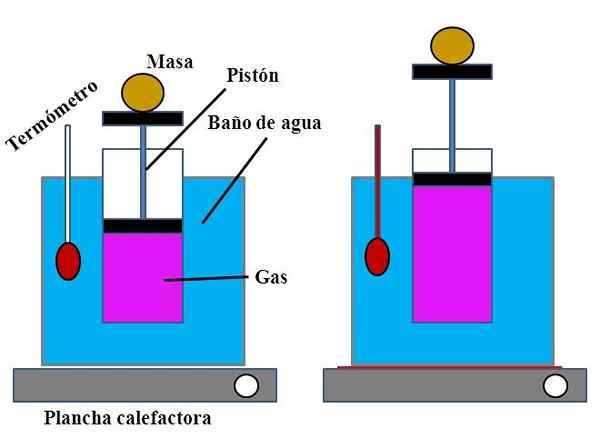 Kokeen kokoonpano Charlesin lain osoittamiseksi. Lähde: Gabriel Bolívar.
Kokeen kokoonpano Charlesin lain osoittamiseksi. Lähde: Gabriel Bolívar. Vesisäiliössä, joka täytti vesihauteen toiminnan, avoin sylinteri asetettiin sen yläosaan, mäntällä, joka säädettiin sylinterin sisäseinään (ylivoimainen kuva).
Tämä mäntä (männän ja kahden mustan emäksen muodostama) voisi siirtyä sylinterin ylä- tai alaosaan sen sisältämän kaasun määrän mukaan riippuen.
Vesihaute voidaan lämmittää käyttämällä kevyempää tai lämmityslaitosta, joka toimitti tarvittavan lämmön kylpyhuoneen lämpötilan nostamiseksi ja siten männällä varustetun sylinterin lämpötilan.
Voi palvella sinua: kalsiumhydroksidi (CA (OH) 2): rakenne, ominaisuudet, hankkiminen, käyttöMännylle asetettiin tietty massa sen varmistamiseksi, että koe suoritettiin vakiopaineessa. Kylpyhuoneen ja sylinterin lämpötila mitattiin käyttämällä vesihauteen asetettua lämpömittaria.
Vaikka luultavasti sylinterillä ei ollut valmistumista ilman tilavuuden visualisoimiseksi, tämä voitaisiin arvioida mittaamalla männän ja sylinteripohjan pinnalle asetettu massa.
Kehitys
Sylinterin tilavuus saadaan kertomalla sen pohjan pinta sen korkeudella. Sylinteripohjan pinta voitiin saada soveltamalla kaavaa: s = pi x r2.
Kun taas korkeus saadaan mittaamalla etäisyys sylinterin pohjasta männään, jolla taikina lepää.
Kun kylpyhuoneen lämpötila nousi kevyemmän tuottaman lämmön avulla, havaittiin, että mäntä nousi sylinterin sisällä. Sitten he lukevat lämpötilan lämpötilassa lämpömittarissa, joka vastasi sylinterin sisätilaa.
Ne mittaavat myös männän taikinan korkeuden, kykenemättä arvioimaan mitattua lämpötilaa vastaavan ilman tilavuuden. Tällä tavoin he tekivät useita lämpötilan mittauksia ja arvioita kutakin lämpötilaa vastaavasta ilmatilavuudesta.
Tämä voisi lopulta osoittaa, että kaasun käyttämä tilavuus on suoraan verrannollinen sen lämpötilaan. Tämän päätelmän sallittiin ilmoittaa niin kutsuttu Charles Law.
Globo jäällä talvella
Edellisen kokeen lisäksi on yksinkertaisempi ja laadullisempi: ilmapallolla jäällä talvella.
Jos talvella pallo on täynnä heliumia huoneessa, jossa on lämmitys, maapallolla olisi tietty tilavuus; Mutta jos siirretään sitten talon ulkopuolelle matalassa lämpötilassa, havaitaan, että heliumpallo kutistuu vähentäen sen tilavuutta Charlesin lain mukaan.
Ratkaisut
Harjoitus 1
Sinulla on kaasu, jonka määrä on 750 cm3 25 ºC: n kohdalla: Mikä on tilavuus, jonka tämä kaasu on 37 ºC: ssa, jos vakiopaine ylläpidetään?
Lämpötilayksiköt ensin on ensin muunnettava Kelviniksi:
T1 Asteina Kelvin = 25 ºC + 273,15 ºC = 298,15 K
T2 Asteina Kelvin = 37 ºC + 273,15 ºC = 310,15 K
Koska se tunnetaan V1 ja muut muuttujat, se tyhjentää V2 Ja se lasketaan seuraavalla yhtälöllä:
V2 = V1 · (T2 / T1-A
= 750 cm3 · (310,15 K / 298,15 K)
= 780,86 cm3
Harjoitus 2
Mikä olisi lämpötila celsiusasteissa, joihin 3 litraa kaasua on lämmitettävä 32 ° C: seen, joten sen tilavuus kasvaa 3,2 litraan?
Kelvinin Celsius -asteet muuttuvat jälleen:
T1 = 32 ºC + 273,15 ºC = 305,15 K
Ja kuten edellisessä harjoituksessa, T puhdistetaan2 V: n sijasta2, ja laskee sitten:
T2 = V2 · (T1 / V1-A
= 3,2 L · (305,15 K / 3 L)
= 325,49 K
Mutta lausunnossa pyydetään celsiusastetta, joten T: n yksikkö muuttuu2-
T2 Celsiusasteissa = 325, 49 º C (k) - 273,15 ºC (k)
Voi palvella sinua: Pascal -ruisku= 52,34 ºC
Harjoitus 3
Jos kaasu 0 ºC: lla on tilavuus 50 cm3, Minkä tilavuuden se vie 45 ºC?
Charlesin lain alkuperäisen kaavan käyttäminen:
Vt = Vjompikumpi (1 + T /273)
Jatka laskentaa Vt Suoraan kun hävität kaikki muuttujat:
Vt = 50 cm3 + 50 cm3 · (45 ºC / 273 ºC (K))
= 58,24 cm3
Toisaalta, jos ongelma ratkaistaan esimerkkien 1 ja 2 strategialla, meillä on:
V2 = V1 · (T2 / T1-A
= 318 K · (50 cm3 / 273 K)
= 58,24 cm3
Tulos, kahden menettelyn soveltaminen, on sama, koska ne perustuvat viime kädessä samaan Charles -lain periaatteeseen.
Sovellukset
Toivoa sappeja
Toiveiden ilmapallot (jo mainitut johdannossa) on varustettu tekstiilimateriaalilla, joka on kyllästetty palavalla nesteellä.
Kun tulipalo ampuu tämän materiaalin, maapallolla on ilman lämpötila, joka aiheuttaa kaasun määrän lisääntymistä Charlesin lain mukaan.
Siksi lisäämällä ilman tilavuutta maapallolla, ilman tiheys vähenee siinä, mikä on vähemmän kuin ympäröivän ilman tiheys, ja siksi maapallo nousee.
Pop-up-lämpömittarit tai kalkkunat
Kuten sen nimellä on ilmoitettu, niitä käytetään kalkkunoiden keittämisen aikana. Lämpömittarilla on säiliö täynnä suljettua ilmaa kannen kanssa ja se kalibroitu siten, että saavutettaessa optimaalista keittolämpötilaa, kansi nostetaan lähettämällä ääni.
Lämpömittari on sijoitettu kalkkunan sisälle, ja lämpötilan noustessa uunin sisällä lämpömittarin sisällä oleva ilma laajenee, mikä lisää sen tilavuutta. Joten kun ilmatilavuus saavuttaa tietyn arvon, se tekee lämpömittarin nostosta.
Ping-pong-pallojen muodon palautuminen
Ping-pong-pallot niiden käyttövaatimuksista riippuen ovat kevyitä ja niiden muoviseinät ovat vähän paksuja. Tämä tekee niistä, joihin mailat kärsivät muodonmuutoksista.
Asettamalla epämuodostuneet pallot kuumaan veteen, ilma lämmitetään ja sen laajeneminen tapahtuu, mikä johtaa ilman tilavuuden lisääntymiseen. Tämä aiheuttaa myös ping-pong-pallojen seinämän, mikä mahdollistaa sen alkuperäisen muodon palautumisen.
Paesin laatiminen
Hiivat sisällytetään vehnäjauhoihin, joita käytetään leivän valmistukseen ja joilla on kyky tuottaa hiilidioksidikaasua.
Nostamalla leivän lämpötilaa kypsennyksen aikana, hiilidioksidin tilavuus kasvaa. Juuri tämän takia leivän laajeneminen tapahtuu, kunnes haluttu tilavuus saavutetaan.
Viitteet
- Clark j. (2013). OTER -kaasulake - Boylen laki ja Charles 'laki. Talteenotettu: Chemguide.yhteistyö.Yhdistynyt kuningaskunta
- Staroscik Andrew. (2018). Charlesin laki. Haettu: SciencePrimeer.com
- Wikipedia. (2019). Charles Law. Haettu: vuonna.Wikipedia.org
- Helmestine, Todd. (27. joulukuuta 2018). Mikä on Charlesin lain kaava? Toipunut: Admingco.com
- Prof. N. Leijona. (S.F.-A. Alkeiskaasulakit: Charles Law. C 101 luokan muistiinpanot. Toipunut: iun.Edu
- Briceño Gabriela. (2018). Charles Law. Toipunut: Euston96.com
- Morris, J. G. (1974). Biologien fysikakemia. (2antaa painos). Toimituksellinen palautus, S.-Lla.
- « Neljätoista pistettä Wilson -taustasta ja miten se vaikutti Saksaan
- Energian, voiman, voiman, työn käsitteiden sovellukset »

