Henryn laki

- 4689
- 1360
- Kelly Kilback
 Henryn laki selittää virvoitusjuomien poreilun
Henryn laki selittää virvoitusjuomien poreilun Mikä on Henryn laki?
Se Henryn laki Suhde kuvaa paineen vaikutusta kaasun liukoisuuteen. Tämä laki osoittaa, että nesteen pinnan kanssa kosketuksessa olevan kaasun liukoisuus tietyssä lämpötilassa on suoraan verrannollinen mainitun kaasun osittaiseen paineeseen nesteessä.
Tämä tarkoittaa, että mitä suurempi nesteen kaasupaine, sitä suurempi on liuennut kaasun kokonaismäärä, mikä saa suuremman konsentraation (ts. Mitä suurempi liukoisuus) saa).
Henryn laki näemme sen toiminnassa joka kerta, kun paljastamme soodajuoman. Suljettuna korkea paine pullon sisällä pitää hiilihiilikaasun liuentuneina. Mutta paljastamalla sen, kaasupaine laskee, mikä vähentää sen liukoisuutta ja karkaa kuplia ja poreilemista.
Henryn laki kaava
Matemaattisessa muodossa Henryn laki ilmaistaan suhteellisuuslaina:
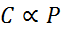
Tämä suhteellisuuslaki muutetaan:
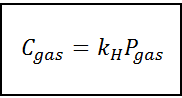
Missä C Se viittaa nesteen kaasupitoisuuteen, toisin sanoen sen liukoisuuteen; Pkaasu Se on kaasun osittainen paine kosketuksessa nesteen kanssa ja k -k -H Se on suhteellisuusvakio, jota kutsutaan Henryn laki vakiona.
Kaasukonsentraatio voidaan ekspressoida eri yksiköissä, kuten molaarisuus, molenssi tai molaarinen fraktio. Useimmissa tapauksissa kemikaalit käyttävät kuitenkin pitoisuutta molaarisuusyksiköissä (mol/l), kun taas paine ilmaistaan ilmakehissä.
Voi palvella sinua: antraseeni: mikä on, rakenne, ominaisuudet, käyttötarkoituksetHenryn lain vakio (k -k -H-A
Vakio k -k -H Kuvaile kaasun ja liuottimen välisiä vuorovaikutuksia. Mitä vahvemmat nämä vuorovaikutukset ovat, sitä suuremmat ovat vakioita ja sitä suurempi kaasun liukoisuus liuottimeen tietyssä lämpötilassa ja paineessa.
Numeerisesti, arvo k -k -H edustaa kaasun liukoisuutta annetussa lämpötilassa, kun saman paine on 1 atm.
Yhtälössä käytetyistä pitoisuus- ja paineyksiköistä riippuen tällä vakiolla voi olla MOL/L -yksiköitä.ATM, mol/kg.ATM, jne.
Seuraava taulukko näyttää Henryn lain vakion arvot joillekin yhteisille kaasuille vedessä 25 ° C: ssa:

Nämä arvot vähenevät lämpötilan kanssa, koska kaasujen liukoisuus yleensä laskee korkeammassa lämpötilassa.
Selitys Henryn laista
Henryn laki on erittäin helppo ymmärtää mikroskooppisesta näkökulmasta. Voimme kuvitella kaasun sarjanaan hyvin pieniä hiukkasia, jotka pomppivat kaikilla pelaamilla pinnoilla. Kun ne törmäävät nesteen pinnan kanssa, jotkut hiukkaset poistuvat, kun taas toiset ylittävät pinnan loukkuun (ts. Ne liukenevat).
Sama koskee kaasuhiukkasia, jotka ovat liuenneet. Ne pomppivat astian seinillä ja voivat myös saavuttaa nesteen pinnan, missä jotkut pomppivat, kun taas toiset ylittävät pinnan ja pakenevat kaasufaasiin.
Kun tasapaino saavutetaan, nopeudet, joilla kaasu liukenee liuottimeen ja jonka kanssa se pakenee, ovat yhtä suuret, joten pitoisuus pysyy vakiona.
Voi palvella sinua: metallien mekaaniset ominaisuudet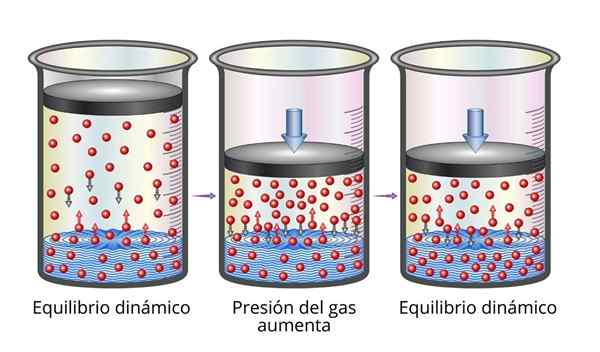 Selitys Henryn laista
Selitys Henryn laista Kun nostamme kaasun painetta, teemme lisäämään taajuutta, jolla kaasuhiukkaset törmäävät nesteen pinnan kanssa. Tämä tekee nopeuden, jolla kaasu liukenee. Kun uusi tasapaino saavutetaan, uusi kaasun pitoisuus on suurempi.
Poikkeuksia Henryn lakiin
On tärkeää korostaa, että Henryn laki on ihanteellinen laki, joka kuvaa vain todellisten kaasuratkaisujen käyttäytymistä tietyissä olosuhteissa. Siten Henryn lakia voidaan soveltaa vain, kun:
- Lämpötila pysyy vakiona.
- Kaasu on tasapainossa liuoksen kanssa.
- Kaasun paine on suhteellisen alhainen.
- Kaasu ei reagoi liuottimen kanssa.
Tästä huolimatta, jopa joissain tapauksissa, joissa kaasu reagoi liuottimen kanssa, tätä lakia voidaan soveltaa suunnilleen.
Esimerkkejä Henryn lain soveltamisesta
Esimerkki 1: Henryn lain vakion määrittäminen
Kokeellisesti määritettiin, että vesipitoisen liuoksen pitoisuus tasapainossa neonin kanssa paineessa 3,00 atm ja 25 ° C on 0,00135 mol/l. Määritä Henryn neonlain vakio vedessä 25 ° C: ssa.
Ratkaisu:
Henryn lain mukaan:
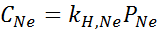
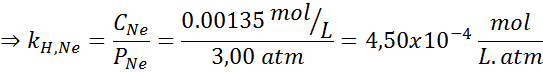
Siksi Henryn laki vakiona vedessä 25 ° C: ssa on 4,50 × 10-4 mol/l.Pankkiautomaatti.
Esimerkki 2: Kaasun liukoisuuden määrittäminen
Määritä ilman hiilidioksidin liukoisuus vedessä merenpinnan tasolla, käyttämällä Henryn lakien vakiota, mikä on merenpinnan hiilidioksidin liukoisuus, tietäen, että mainitun kaasun molaarinen osuus ilmassa on 3,14 × 10-4.
Ratkaisu:
Merenpinnalla ilmanpaine on 1 atm ja Co: n osittainen paine2 Se on annettu:
Se voi palvella sinua: hypoloodinen happo (HIO)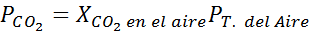
Tämän ilmaisun korvaaminen Henryn laissa:
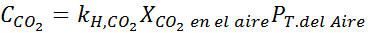
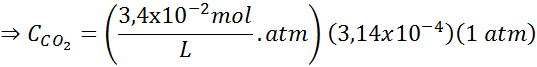
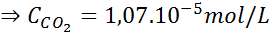
Esimerkki 3: Sukelluskaasut
Kun sukeltaja ei ole suurempi kuin 30 metriä, ilmaseoksen on hengitettävä muiden inerttien kaasujen, kuten heliumin tai argonin, kanssa, koska Henryn lain mukaan ennustetun veren typpipitoisuuden lisääntymisellä on huumausaineita, jotka aiheuttavat häiriintymistä, sekaannusta ja visiota ongelmat.
Tämä vaikutus alkaa havaita hengittäessään ilmaa (xN2= 0,78) paineessa 4,00 atm. Jos sukeltaja aikoo laskeutua jopa 100 metrin syvyyteen, missä paine on noin 11,0 atm, mikä on suurin typpifraktio, joka voi hengittää ennen huumekauppiaista kärsiviä?
Ratkaisu:
Lauseen perusteella voimme päätellä, että typen suurin pitoisuus tapahtuu, kun ilmanpaine on 4,00 atm. Henryn lain mukaan ja edellisen esimerkin kokonaispaineen ja osittaisen paineen välinen suhde:
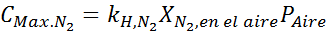
Tämän on oltava sama enimmäispitoisuus missä tahansa kokonaispainossa. Joten, 100 metriä:
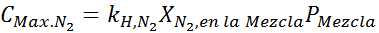
Tasaamalla molemmat yhtälöt, löydämme seoksesta typen maksimi -molaarisen fraktion:
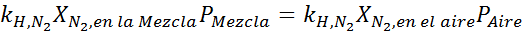
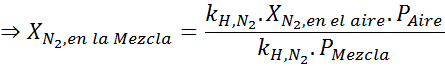
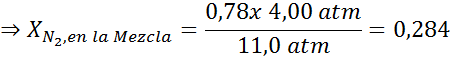
Tämä tarkoittaa, että sukeltajan ei tulisi käyttää seosta, joka sisältää yli 28,4% typpeä, jos se aikoo sukeltaa jopa 100 metrin syvyyteen.

