Ritchter-Wenzel Law Mikä on, tarinoita, lausuntoja, esimerkkejä
- 2891
- 819
- Gustavo Runte DVM
Se Ritchter-Wenzelin laki tai vastavuoroisista mittasuhteista on sellainen, joka osoittaa, että kahden yhdisteen väliset massaosuudet sallivat määrittää kolmannen yhdisteen osuuden. Se on yksi stökiometrian laeista yhdessä Lavoisierin (massan säilyttämislaki) kanssa; Proust -laki (määriteltyjen mittasuhteiden laki); ja Daltonin laki (useiden mittasuhteiden laki).
Ritcher ilmoitti lainsa vuonna 1792 kirjassa, joka määritteli stoikiometrian perustan, joka perustui Carl F Wenzelin tutkimustyöhön, joka julkaisi vuonna 1777 ensimmäisen ekvivalenssitaulukon happojen ja emäksille.
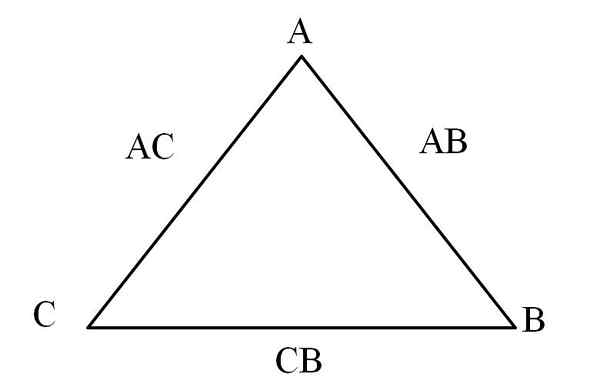
 Vastavuoroisuus kolmio. Lähde: Gabriel Bolívar
Vastavuoroisuus kolmio. Lähde: Gabriel Bolívar Yksinkertainen tapa visualisoida se on "vastavuoroisuus kolmion" (ylivoimainen kuva) kautta. Jos tiedetään A, C ja B massat, jotka sekoitetaan AC- ja AB -yhdisteiden muodostamiseksi, voidaan määrittää, kuinka suuri osa C: stä ja B: stä sekoitetaan tai reagoivat CB -yhdisteen muodostamiseksi.
Yhdisteissä AC ja AB elementti A on läsnä molemmissa, joten niiden massa -osuuksien jakautuessa on se, kuinka paljon C reagoi B: n kanssa.
[TOC]
Vastavuoroisten mittasuhteiden historia ja yleisyys
Richter havaitsi, että kemiallisessa reaktiossa kulutettujen yhdisteiden painoprosentti on aina sama.
Tältä osin Ritcher havaitsi, että magnesian (MGO) painon mukaan 615 osaa vaaditaan 1000 rikkihapon painon neutraloimiseksi.
Vuosina 1792–1794 Ritcher julkaisi yhteenvedon kolmesta osasta, jotka sisälsivät hänen työnsä määriteltyjen mittasuhteiden laki. Yhteenveto kokeili stökiometriaa määrittelemällä sen kemiallisten mittausten taiteena.
Voi palvella sinua: Hienokerroksen kromatografia: Ominaisuudet, mitä se onOsoittaen lisäksi, että stökiometria käsittelee lakeja, joiden mukaan aineita yhdistetään yhdisteiksi. Richterin tutkimusteoksia kuitenkin kritisoitiin hänen käyttämäänsä matemaattisesta kohtelusta, huomauttaen, että hän mukautti tuloksiaan.
Vuonna 1802 Ernst Gottfried Fischer julkaisi ensimmäisen kemiallisten ekvivalenttien taulukon, jossa käytettiin rikkihappoa kuviolla 1000; Samanlainen kuin Richterin löytämä arvo, rikkihapon neutraloimiseksi magnesialla.
On kuitenkin huomautettu. Esimerkiksi on osoitettu, että 859 NaOH -osaa neutraloi 712 HNO: n osaa3.
Lausunnot ja seuraukset
Richter-Wenzelin lain lausunto on seuraava: kahden eri elementin massat, jotka yhdistetään samaan määrään kolmannen elementin, pitävät samat suhteet kuin näiden elementtien massat yhdistettynä toisiinsa.
Tämä laki mahdollisti vastaavan painon tai painohave-gramman, kuten elementin tai yhdisteen määrän, määrittämisen, joka reagoi kiinteän määrän referenssiaineen kanssa.
Richter kutsui yhdistelmäpainona, jotka liittyvät elementtien painoihin, jotka yhdistettiin jokaiseen vety grammaan. Richterin suhteelliset yhdistelmäpainot vastaavat sitä, mitä tällä hetkellä tunnetaan elementtien tai yhdisteiden vastaavana painona.
Edellisen lähestymistavan mukaisesti Richter-Wenzelin laki voidaan ilmaista seuraavasti:
Eri elementtien yhdistelmäpainot, jotka yhdistetään tietyn elementin tiettyyn painoon, ovat näiden elementtien suhteelliset yhdistelmäpainot yhdistettynä toisiinsa tai näiden määrien suhteiden monikertoimia tai alistuksia.
Se voi palvella sinua: Heterogeenisten seosten erottamismenetelmätEsimerkit
Kalsiumkloridi
Kalsiumoksidissa (CAO) 40 g kalsiumia yhdistetään 16 g happea (O). Samaan aikaan hypokloorioksidissa (Cl2O), 71 g klooria yhdistetään 16 g: n happea. Mikä yhdiste kalsiummuoto yhdistetään klooriin?
Käyttämällä vastavuoroisuuskolmiota, happi on kahden yhdisteen yleinen elementti. Kahden hapettuneen yhdisteen massasuhteet määritetään ensin:
40 g ca/16 go = 5 g ca/2 g tai
71g Cl/16G tai
Ja nyt jakamalla kaksi Caon ja Cl: n massaosuuksia2Tai meillä on:
(5 g ca/2 g o)/(71 g cl/16 g o) = 80 g ca/142 g cl = 40 g ca/71 g cl
Huomaa, että massaosuuksien laki täyttyy: 40 g kalsium reagoi 71 g klooria.
Rikkioksidit
Happi ja rikki reagoivat kuparin kanssa vastaavasti kuparin (CUO) ja kuparisulfidin (CUS) antamiseksi. Kuinka paljon rikki reagoi hapen kanssa?
Kuparioksidissa 63,5 g kuparia yhdistetään 16 g happea. Kuparisulfidissa 63,5 g kuparia yhdistetään 32 g rikkiä. Jakamalla massa -mittasuhteet:
(63,5 g cu/16 g o)/(63,5 g cu/32 g s) = 2032 g s/1016g o = 2 g s/1g tai
Massamäärä 2: 1 on 4 (63,5/16), joka osoittaa, että Richterin laki on täytetty. Tällä osuudella saadaan niin, että rikki monoksidi (32 g rikki reagoi 16 g happea) saadaan.
Jos tämä osuus on jaettu kahdella, siellä on 1: 1. Jälleen se on nyt 4 tai 2, ja siksi se on niin2, Rikkidioksidi (32 g rikki reagoi 32 g happea).
Voi palvella sinua: Fucosa: Ominaisuudet, rakenne, toiminnotSulfidi- ja rautaoksidi
Rautasulfidi (FES) reagoitiin, jossa 32 g rikkiä yhdistetään 56 g rautaa, rauta- (ruma) oksidilla, jossa 16 g happea yhdistetään 56 g rautaa. Tämä elementti toimii viitteenä.
FES: ssä ja rumaissa reagoivissa yhdisteissä rikki (S) ja happi (O) suhteessa 2: 1 havaitaan raudan (usko). Rikkioksidissa (SO) 32 g rikkiä yhdistetään 16 g happea, joten rikki ja happi löytyvät suhteessa 2: 1.
Tämä osoittaa, että vastavuoroisten mittasuhteiden laki tai Richterin laki täyttyy.
Rikin ja hapen välistä osuutta rikkioksidin (2: 1) välillä voitaisiin käyttää esimerkiksi laskemaan kuinka paljon happea reagoi 15 g: n rikkiä.
o happi g = (15 g s) ∙ (1 g o/2 g s) = 7,5 g
Viitteet
- Vastavuoroisen osuuden laki: Määritelmä ja esimerkki. Opiskelu. Toipunut: Opiskelu.com
- Vastavuoroisten mittasuhteiden laki. Kemian librettexts. Palautettu: Chem.Librettexts.org

