Mikrofilamenttien ominaisuudet, rakenne, toiminnot, patologia
- 2498
- 184
- Dr. Travis Reichert
Se mikrofilamentit o Aktiinifilamentit ovat yksi eukaryoottisolujen sytoskeleiden kolmesta peruskomponentista.
Eukaryooteissa aktiinimikrofilamenttien koodaavat geenit ovat erittäin säilyneet kaikissa organismeissa, joten niitä käytetään usein molekyylimarkkereina eri tutkimuksiin.
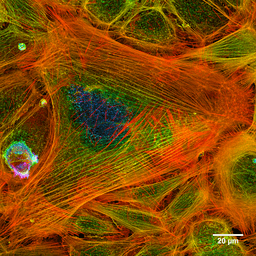
 Valokuva värjätyn solun aktiinifilamenteista (lähde: Howard Vindin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Valokuva värjätyn solun aktiinifilamenteista (lähde: Howard Vindin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Mikrofilamentit jakautuvat koko sytosoliin, mutta ne ovat erityisen runsaasti taustalla olevalla alueella plasmamembraaniin, missä ne muodostavat kompleksisen verkon ja liittyvät muihin erityisiin proteiineihin sytoskeletonin muodostamiseksi.
Nisäkkäiden solujen sytoplasman mikrofilamenttiverkot koodaavat kaksi aktiinille kuvattuista kuudesta geenistä, jotka ovat mukana mikrofilamenttien dynamiikassa ja jotka ovat jopa erittäin tärkeitä kantasolujen erilaistumisen aikana.
Monet kirjoittajat ovat yhtä mieltä siitä, että mikrofilamentit ovat useimpien eukaryoottisolujen sytoskeleton monimuotoisimpia, monipuolisimpia ja tärkeimpiä proteiineja, ja on tärkeää muistaa, että näitä ei löydy prokaryoottisista mikro -organismeista.
Tämän tyyppisissä soluissa on kuitenkin homologisia filamentteja mikrofilamenteille, mutta ne muodostavat toisen proteiinin: MREB -proteiini.
Tällä hetkellä ajatellaan, että tätä proteiinia koodaavan geenin on mahdollinen esi -isien geeni eukaryoottiselle aktiinille. MREB -proteiinia muodostava aminohapposekvenssihomologia on kuitenkin vain 15% aktiinisekvenssin suhteen.
Kuten sytoskeletonin perustavanlaatuinen osa, mikä tahansa fenotyyppinen vika sekä mikrotubuluksissa että välituotteiden ja aktiinimikrofilamenteissa (sytoskeleton) voivat aiheuttaa erilaisia solu- ja systeemisiä patologia.
[TOC]
Ominaisuudet ja rakenne
Mikrofilamentit koostuvat aktiiniperheen proteiinimonomeereistä, jotka ovat erittäin runsaasti supistuvia proteiineja eukaryoottisoluissa, koska ne myös osallistuvat lihasten supistumiseen.
Näiden filamenttien halkaisija on välillä 5 - 7 nm, joten ne tunnetaan myös ohuina filamenteina ja ne koostuvat kahdesta aktiinimuodosta: globaali muoto (aktiini G) ja rihmamuoto (aktiini F).
Proteiinit, jotka osallistuvat sytoskeletoniin.
Voi palvella sinua: sytoplasma: toiminnot, osat ja ominaisuudetGlobaalin aktiinin ja rihamahdollisen aktiinin osuus sytosolissa riippuu solujen tarpeista, koska mikrofilamentit ovat hyvin vaihtelevia ja monipuolisia rakenteita, jotka ovat jatkuvasti kasvua ja lyhentymistä polymeroinnin ja depolymeterisoinnin vuoksi.
Aktiini G on pieni globaali proteiini, joka koostuu lähes 400 aminohapposta ja noin 43 kDa: n molekyylipainoista.
Aktiini G -monomeerit, jotka muodostavat mikrofilamentit, tilataan kierteisen juosteen muodossa, koska jokainen kärsii vääntöstä, kun se liittyy seuraaviin.
Aktiini G liittyy CA2+ -molekyyliin ja toiseen ATP: hen, jotka stabiloivat sen globaalin muodon; Vaikka aktiini F saadaan ATP -molekyylin terminaalisen fosfaatin hydrolyysin jälkeen aktiinissa G, joka myötävaikuttaa polymerointiin.
Organisaatio
Aktiinifilamentit voidaan järjestää "palkkien" tai "verkkojen" muodossa, joilla on erilaiset toiminnot solujen sisällä. Palkit muodostavat rinnakkaiset rakenteet, jotka on kytketty melko jäykillä ristisilloilla.
Verkot puolestaan ovat mukavampia rakenteita, kuten kolmiulotteisia silmiä, joilla.
On monia proteiineja, jotka liittyvät aktiini- tai mikrofilamenttifilamenteihin ja jotka tunnetaan nimellä ABP (englanniksi Aktiinia sitovat proteiinit), joilla on erityisiä sivustoja tähän.
Monet näistä proteiineista sallivat mikrofilamenttien vuorovaikutuksessa sytoskeleton kahden muun komponentin kanssa: mikrotubulukset ja välituotteet, samoin kuin plasmamembraanin sisäpinnan muiden komponenttien kanssa.
Muiden mikrofilamenttien kanssa vuorovaikutuksessa olevien proteiinien joukossa ovat ydinlevyt ja spektri (punasoluissa).
Kuinka aktiinifilamentit muodostetaan?
Koska globaalit aktiinimonomeerit liittyvät aina samalla tavalla, suuntautuneena samaan suuntaan, mikrofilamenteilla on määritelty napaisuus, kahdella äärimmäisyydellä: yksi "enemmän" ja yksi "vähemmän".
Näiden filamenttien napaisuus on erittäin tärkeä, koska ne kasvavat huomattavasti nopeammin positiivisen päänsä vuoksi, johon lisätään uudet aktiini -g -monomeerit.
 Aktiinimikrofilamenttien graafinen esitys (lähde: johdannainen työ: Rtama (Talk) ohut_filament_formaatio.SVG: Mikael Häggström [julkinen alue] Wikimedia Commonsin kautta)
Aktiinimikrofilamenttien graafinen esitys (lähde: johdannainen työ: Rtama (Talk) ohut_filament_formaatio.SVG: Mikael Häggström [julkinen alue] Wikimedia Commonsin kautta) Ensimmäinen asia, joka tapahtuu aktiinifilamenttien polymeroinnin aikana, on prosessi, joka tunnetaan nimellä "ytimenmuutos", joka koostuu kolmen proteiinimonomeerin assosiaatiosta.
Voi palvella sinua: PlasomolyysiTähän trimmeriin uudet monomeerit lisäävät molemmat päät, niin että filamentti kasvaa. Aktiini G-monomeerit kykenevät hydrolyz-ATP: hen jokaisen liiton kanssa, jolla on vaikutuksia polymeroinnin nopeuteen, koska aktiini-ATP-osat eroavat vaikeuksista kuin aktiini-adp.
ATP ei ole välttämätöntä polymeroinnin kannalta, eikä sen hydrolyysin betonin toimintaa ole vielä selkeytetty.
Jotkut kirjoittajat katsovat, että koska aktiinipolymerointitapahtumat ovat nopeita.
Säätö
Sekä aktiinifilamenttien polymerointi että sen depolimerisaatio ovat prosesseja, joita säädetään erittäin spesifisiä proteiineja, jotka ovat vastuussa filamenttien uusinnasta.
Esimerkki proteiineista, jotka säätelevät depolymeerejä. Toisella proteiinilla, profylainilla, on päinvastainen funktio, koska se stimuloi monomeerien assosiaatiota (stimuloimalla ADP: n vaihtoa ATP: hen).
Funktiot
Mikrofilamentit ovat vuorovaikutuksessa myosiinilankojen kanssa, jotka liittyvät transmembraanisiin proteiineihin, joilla on domeeni sytosolissa ja toinen ulkomailla, joten ne osallistuvat solujen liikkuvuusprosesseihin.
Nämä plasmamembraaniin liittyvät mikrofilamentit välittävät erilaisia soluvasteita erityyppisille ärsykkeille. Esimerkiksi epiteelikudosten solujen tarttuminen ohjaavat kadheriinina tunnetut transmembraaniset proteiinit, jotka ovat vuorovaikutuksessa mikrofilamenttien kanssa vastetekijöiden rekrytoimiseksi.
Aktiinifilamentit ovat vuorovaikutuksessa välituotteiden kanssa, jotta solunulkoiset ärsykkeet saavat aikaan avainpaikkoihin, kuten ribosomeihin ja kromosomeihin ytimen sisällä.
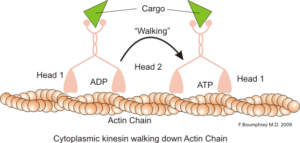 Aktiinimikrofilamenttien solunsisäisen motorisen toiminnan esittäminen (lähde: boumphreyfr [cc by-sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Wikimedia Commonsin kautta)
Aktiinimikrofilamenttien solunsisäisen motorisen toiminnan esittäminen (lähde: boumphreyfr [cc by-sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Wikimedia Commonsin kautta) Mikrofilamenttien klassinen ja hyvin tutkittu toiminta on sen kyky muodostaa ”siltoja”, “kiskoja” tai “moottoriteitä” myosiinin motorisen proteiinin I liikkumiseen, joka kykenee kuljettamaan vesikkeleitä organelista kalvoplasmaan eritystilaan polkut.
Mikrofilamentit ovat myös vuorovaikutuksessa myosiini II: n kanssa sytokiinien aikana muodostuneen supistuvan renkaan luomiseksi, tarkasti solunjaon viimeisen vaiheen aikana, jossa sytosoli erotetaan kantasoluista ja tytärsoluista.
Voi palvella sinua: polymorfonukleaariset leukosyytitYleensä aktiinin muotoiset mikrofilamentit moduloivat joidenkin organelien, kuten Golgi -kompleksin, endoplasmisen retikulumin ja mitokondrioiden jakautumista. Lisäksi he osallistuvat myös RNM: ien alueelliseen sijaintiin niin, että ribosomit lukevat ne.
Koko matkapuhelinjoukko mikrofilamentteja, etenkin niitä, jotka liittyvät läheisesti plasmamembraaniin, osallistuvat solujen aaltoilevien solukalvojen muodostumiseen, joilla on jatkuva aktiivinen liike.
He osallistuvat myös mikrovirtojen ja muiden yleisten ulkoneman muodostumiseen monien solujen pinnalla.
Esimerkki maksan toiminnoista
Mikrofilamentit osallistuvat sappeen eritysprosessiin hepatosyytteissä (maksasolut) ja myös peristaltisissa liikkeissä (koordinoitu supistuminen) maksa -kanavassa.
Ne edistävät plasmamembraanidomeenien erottelua heidän yhteydenpidon ansiosta erilaisten sytosolisten elementtien ja näiden solunsisäisten elementtien topografian hallinnan ansiosta.
Aiheeseen liittyvät patologiat
Rakenteessa on vähän sairauksia, jotka liittyvät rakenteessa tai proteiineihin ja sääteleviin entsyymeihin mikrofilamenttien synteesissä, vaikka nämä ovat suoraan mukana suuressa määrässä toimintoja.
Mikrofilamenttien primaarirakenteen alhainen sairauksien ja epämuodostumien indeksi johtuu tosiasiasta, että sekä aktiinin että sen säätelyproteiinien, ilmiön, nimellä "geneettinen redundanssi", on yleensä useita koodaavia geenejä, "geneettinen redundanssi".
Yksi tutkituimmista patologioista on munasolujen lasitus niiden sytoskeletonissa, jossa aivokuoren mikrofilamenttiverkossa havaitaan keskeytymistä, samoin kuin depolimerisaatio ja mitoottisen kärjen mikrotubulusten hajoaminen.
Yleisesti ottaen tämä lasitus aiheuttaa kromosomaalisen dispersion, koska se johtaa erimielisyyteen koko kromatiinin tiivistämisessä.
Solut, joilla on suurempi organisaatio ja osuus mikrofilamenteista sytoskeletonissa, ovat strnettuja lihassoluja, joten suurin osa patologioista liittyy supistuvien laitteiden toimintahäiriöihin.
Viallisiin tai epätyypillisiin mikrofilamenteihin on liitetty myös luusairaus, joka tunnetaan nimellä Paget -tauti.
Viitteet
- Aguilar-Cuenca, R., Llorente-González, c., Vicente, c., & Vicente-Manzanares, M. (2017). Mikrofilamentti-koordinoitu tarttuvuusdynamiikka ajaa yksisoluisia migraatiota ja muotoilee kudoksia. F1000Resarch, 6.
- Kaksi lääkettä, c. G., Chhabra, D., Kekic, m., Sormi, minä. V., Tsubakihara, M., Berry, D. -Lla., & Nosworthy, N. J -. (2003). Sitoutuvat proteiinit aktiini: sytoskeletaalisten mikrofilamenttien säätely. Fysiologiset arvostelut, 83(2), 433-473.
- Guo, h., Fauci, l., Shelley, m., & Kanso, ja. (2018). Kaikuudellisuus aktivoitujen mikrofilamenttien synkronoinnissa. Journal of Fluid Mechanics, 836, 304-323.
- Tuoda markkinoille., Langer, r., & Vacanti, J. P. (Toim.-A. (2011). Kudostekniikan periaatteet. Akateeminen lehdistö.
- Robbins, J. (2017). Sytoskeleton sairaudet: deminopatiat. Lasten ja sinun aikuisten sydänlihaksen myopatioissa (PP. 173-192). Akateeminen lehdistö.
- « Grizzly Bear -ominaisuudet, elinympäristö, ruoka, käyttäytyminen
- CISTUS Clusii -ominaisuudet, taksonomia, elinympäristö, jakelu, käyttö »

