Dalton Atomic -malli

- 1162
- 110
- Shawn Stanton II
Selitämme Daltonin atomimallin, hänen postulaatit ja rajoitukset
 Daltonin atomimalli perustui ensimmäisenä tieteelliseen tutkimukseen. Lähde: f. Zapata.
Daltonin atomimalli perustui ensimmäisenä tieteelliseen tutkimukseen. Lähde: f. Zapata. Mikä on Daltonin atomimalli?
Hän Dalton Atomic -malli Se ehdottaa, että kaikki aine koostuu pienistä ja jakamattomista yksiköistä, joita kutsutaan atomeiksi, ja siten nostaen ideoita, jotka entiset kreikkalaiset ajattelijat olivat muotoiltuja kaksituhatta vuotta sitten.
Se on ensimmäinen atomimalli, joka syntyi laboratoriossa huolellisesta kokeilusta, koska vaikka ihmiskunta on aina yrittänyt ymmärtää, mikä on yhdeksännentoista vuosisadan alkuun, teorioiden kokeellisesti tarkistamismahdollisuudet olivat edelleen rajoitetut.
Sen lisäksi, että hän on hyvä luonnon tarkkailija, englannin opettaja John Dalton (1766-1844) erottui myös instrumentointien alalta, koska hän loi useita mittauslaitteita, joita hän myöhemmin käyttäisi laboratoriossaan tutkimuksen tutkimiseen kaasut.
Siten Dalton tajusi, että aineet yhdistetään tiettyjen sääntöjen noudattamisen jälkeen, ja selittääkseen sen, että kaikki aine koostui atomeista, pienistä, homogeenisista palloista ja puuttuvasta sisäisestä rakenteesta. Hänen mukaansa atomit muodostavat yhdisteitä tiettyjen mittasuhteiden jälkeen, ja kemiallisen reaktion aikana ne erottuvat ja yhdistyvät uudelleen, luomalla uusia yhdisteitä.
Dalton ei vain kehittänyt ensimmäistä atomimallia, joka perustuu tiukkaan kokeiluun. Hän loi myös elementtien nimikkeistöjärjestelmän, määräsi heidät heidän atomipainonsa vuoksi, perusti useiden mittasuhteiden lain, osittaisten paineiden lain ja kuvasi sokeutta tiettyihin väreihin, ehtoon, jonka hän itse kärsi, nimeltään värisokeus.
Hänen laaja panoksensa tieteeseen ansaitsi lukuisia eroja koko tieteellisen uransa ajan, mutta Dalton asui aina vaatimattomasti ja yksinkertaisella tavalla, omistettu tieteelle päivien loppuun saakka.
Lyhyt tarina
Etäaikoista lähtien ihmiskunta on etsinyt selitystä aineen luonteesta. Kreikkalaiset ajattelijat 5. vuosisadalta.C, ja ennen kuin he, jotkut hindufilosofit, postuloivat, että asia muodostivat atomeiksi kutsuttuja yksiköitä. Heillä ei kuitenkaan ollut tarvittavaa kokeellista tukea teoriansa tarkistamiseksi.
Voi palvella sinua: mitkä ovat lämpöominaisuudet ja mitkä ovat? (Esimerkkejä)Ensimmäinen atomimalli johtuu Leuciposta ja hänen Democritus -opetuslapsestaan Abderan (460. C. - 370 a. C.-A. Ensimmäisestä pienestä siitä lähtien se tunnetaan, mutta Democritus oli suuren tunnettu viisas, verrattavissa Platoniin ja Aristoteleen, vaikka hänen työstään muutama fragmentti on tuskin säilynyt.
Democritus piti atomin lopulliseksi hiukkaseksi, joka muodostaa asian, jakamattoman ja tuhoutumattoman. Heidän teoriansa mukaan kaikki aine koostui näistä hiukkasista, liian pienistä nähdäksesi. Ja yhdistämistavan mukaan atomit tarjosivat kohteen niiden ominaispiirteet.
Toisin kuin tämä, kommentoinnin jälkeen. Aristoteleen jatkuvat ideat voittivat lopulta 1800 -luvun alkuun asti.
Daltonin teokset
Vuonna 1793 John Dalton oli kiinnostunut meteorologiasta ja jatkoi työskentelyä ilmakehän kaasujen ja niiden ominaisuuksien tutkimisessa. Kokeilunsa ansiosta hän huomasi, että elementit, kuten happi, yhdistyivät aina tietyssä osassa, antama kokonaisluku.
Vuonna 1803 Dalton selitti, että nämä mittasuhteet johtuvat siitä, että asia koostuu perushiukkasista, nimeltään Atome, kuten Democit sanoi kauan sitten. Hän esitteli ehdotuksensa teoksessa "Uusi kemian filosofian järjestelmä", jossa hän kuvasi kokeidensa tuloksia.
Lisäksi kyseiseen työhön sisältyi myös erityisiä symboleja, jotka edustavat kunkin elementin yksittäisiä atomeja, jolloin loitaan nykyaikaisen kemian perusta.
Voi palvella sinua: Akuutt äänet: Ominaisuudet ja esimerkitSelitys Dalton Atomic -mallista
Aikana, jolloin Dalton kehitti hänen työnsä, muut tutkijat olivat jo löytäneet joitain aiheita ja elementtien välisiä yhdistelmiä: Antoine Lavoisier -yhdistelmiä totesi, että kemiallisen reaktion aikana massaa ei luoda tai tuhota, vaan siitä tulee, mutta siitä tulee.
Tätä lakia seurasi Proustin määriteltyjen mittasuhteiden laki, jonka mukaan kun kaksi elementtiä yhdistetään, he tekevät niin aina kiinteissä mittasuhteissa.
Nyt osa Daltonin kokeista koostui veden imeytymisen tutkimisesta vedessä. Siellä hän havaitsi, että tietty vesitilavuus voisi absorboida vain tietyn määrän kaasua ja että kyseinen määrä vaihteli kaasun mukaan. Lisäksi kaasua voitaisiin palauttaa vedestä pitämällä sen ominaisuudet ehjinä.
Hän oli myös huomannut, että kun kaksi elementtiä voidaan yhdistää, jotta ne saavat aikaan useamman kuin yhden yhdisteen, kunkin jäännöksen määrä on kiinteä ja pitämällä yksinkertainen numeerinen suhde, esimerkiksi 1: 1, 1: 2; 2: 3 ja niin edelleen. Tämä on puhelu Usean mittasuhteen laki.
Näiden tosiasioiden selittämiseksi Dalton väitti, että kaasu, vesi ja yleensä kaikki aine koostuu peruskappaleista, jotka yhdistettynä synnyttävät erilaisia yhdisteitä. Jokainen elementti koostuu erottuvista hiukkasista (Dalton ei kutsunut niitä atomeiksi alussa), mutta jopa yhdessä sellaiset hiukkaset ylläpitävät muuttumattomia ominaisuuksiaan.
Daltonin atomimalli postuloi
Daltonin atomimalli on esitetty seuraavissa lauseissa:
1. Aine muodostuu pienistä jakamattomista hiukkasista, joita kutsutaan atomeiksi.
2. Jokainen elementti koostuu identtisistä atomeista toistensa kanssa ja yhtä suuret ominaisuudet. Elementin atomit eroavat toisten atoista.
3. Liittymällä kahteen tai useampaan eri elementtien atomiin, ne tekevät niin tietyissä ja yksinkertaisissa mittasuhteissa, luomalla siten yhdisteet, jotka muodostuvat molekyyleillä. Tietyn yhdisteen molekyylit ovat identtisiä toistensa kanssa.
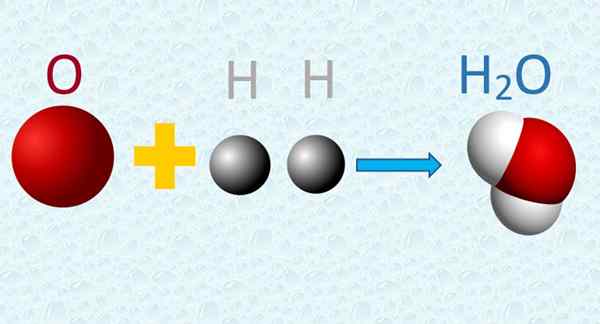 Vesimolekyylissä happi- ja vetyatomit yhdistetään yksinkertaisesti. Lähde: f. Zapata.
Vesimolekyylissä happi- ja vetyatomit yhdistetään yksinkertaisesti. Lähde: f. Zapata. 4. Kemiallisen reaktio -atomit vaihdetaan, mutta ne eivät kärsi muutoksista, eikä niitä luotu tai tuhota prosessissa.
Dalton -mallin epäonnistumiset
Tieteellinen tutkimus kokenut huomattavan puomin 1800 -luvulla, jota edistää teollisuusvallankumous. Ja Daltonin atomimallin tärkeimmät viat eivät paljastettu:
Voi palvella sinua: Pintapuolinen jännitys: Määritelmä, yhtälö, yksiköt ja mittaus1. Atomi ei ole jakamattomia
Tämä on yksi Daltonin atomimallin tärkeimmistä epäonnistumisista. Yhdeksännentoista ja kahdennenkymmenennen vuosisadan aikana suoritetut kokeet osoittivat, että atomi koostuu monista subatomisista hiukkasista.
Ensimmäiset, jotka tunsivat toisensa, olivat elektroni ja protoni, ja myöhemmin se on oppinut neutronin olemassaolosta. Sitten sekä protoni että neutroni paljastivat sen sisäisen rakenteen.
2. Saman elementin atomit eivät välttämättä ole identtisiä
Elementeillä on isotooppeja, jotka, vaikka niillä on samat kemialliset ominaisuudet, eroavat neutronien lukumäärästä, joten niiden atomipaino on erilainen. Esimerkiksi vety -isotoopit ovat protio, deuterium ja tritium.
3. Atomit eivät ole muuttumattomia
On radioaktiivisia aineita, jotka säteilevät hiukkasia ja energiaa, muuttuen muiksi elementeiksi.
4. Atomit eivät aina yhdistä kokonaisia mittasuhteita
On todistettu, että on orgaanisia, monimutkaisempia yhdisteitä, jotka eivät noudata tarkalleen Daltonin useita mittasuhteita.
Kiinnostavia artikkeleita
Schrödinger Atomic -malli.
Broglie -atomimalli.
Chadwick Atomic -malli.
Heisenberg Atomic -malli.
Perrin Atomic -malli.
Thomson Atomic -malli.
Dirac Jordan Atomic -malli.
Democritus Atomic -malli.
Leucpo -atomimalli.
Bohr -atomimalli.
Rutherford Atomic -malli.
Nykyinen atomimalli.

