Kalsiumnitraatti (CA (NO3) 2)

- 1673
- 426
- Gabriel Fahey
Hän kalsiumnitraatti Se on tertiäärinen epäorgaaninen suola, jonka kemiallinen kaava on CA (ei3-A2. Kaavasta tiedetään, että sen kiinteä koostuu Ca -ioneista2+ ja ei3- 1: 2 -suhteessa. Siksi se on puhtaasti ionisen luonteen yhdiste.
Yksi sen ominaisuuksista on sen hapettava luonne nitraatti -anionin seurauksena. Se ei ole polttoainetta, ts. Se ei palaa korkeissa lämpötiloissa. Koska se on poltto, se edustaa turvallista kiinteää manipuloida sitä ilman suurta hoitoa; Se voi kuitenkin nopeuttaa palavien materiaalien sytytystä.
 Kiinteä kalsiumnitraatti. Lähde: Ondřej Mangl [julkinen alue], Wikimedia Commons
Kiinteä kalsiumnitraatti. Lähde: Ondřej Mangl [julkinen alue], Wikimedia Commons Sen ulkonäkö koostuu rakeisesta kiinteästä kiinteästä aineesta, joka on vaalean valkoinen tai harmaa väri (ylivoimainen kuva). Se voi olla vedetöntä tai tetrahydraatti, Kalifornia (ei3-A2· 4H2JOMPIKUMPI. Se on hyvin liukoinen veteen, metanoliin ja asetoniin.
Kalsiumnitraattia on käytetty laajasti lannoitteena, koska se liikkuu helposti kosteassa maaperässä ja kasvien juuret imevät nopeasti. Toimittaa kaksi tärkeää elementtiä kasvien ravitsemukselle ja kasvulle: typpi ja kalsium.
Typpi on yksi kolmesta olennaisesta osasta kasvien (N, P ja K) kehittymiseen, se on välttämätöntä proteiinisynteesissä. Samaan aikaan kalsium on välttämätöntä kasvien soluseinämän rakenteen ylläpitämiseksi. Tästä syystä CA (ei3-A2 Puutarhat ovat erittäin tarkoitettu.
Toisaalta tällä suolalla on myrkyllisiä vaikutuksia, etenkin suoralla kosketuksella ihon ja silmien kanssa, samoin kuin sen pölyn hengittäminen. Lisäksi se voidaan hajottaa lämmittämällä.
Kalsiumnitraattirakenne
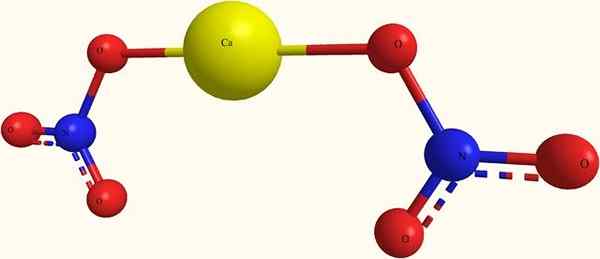 Kalsiumnitraatti -ionit. Lähde: я.Hardnox ru.Wikipedia [julkinen alue], Wikimedia Commonsista
Kalsiumnitraatti -ionit. Lähde: я.Hardnox ru.Wikipedia [julkinen alue], Wikimedia Commonsista Yläkuvassa CA: n rakenne (ei3-A2 Pallo- ja baarimallissa. Tässä on kuitenkin vika: CA-O-kovalenttisten sidosten olemassaolo oletetaan, mikä on ristiriidassa sen ionisen luonteen kanssa. Tämän selventäminen, vuorovaikutukset ovat todella sähköstaattisia.
Kationi ca2+ Sitä ympäröi kaksi anionia ei3- Sen mittasuhteiden mukaan. Typpi nitraatin muodossa kiteisessä rakenteessa hallitseva.
Ionit on ryhmitelty siten, että ne muodostavat kokoonpanon, jonka minimaalinen lauseke on yhtenäinen solu; Mikä on vedettömän suolan kannalta kuutiometriä. Toisin sanoen kuutioista, jotka sisältävät 1: 2 -osuuden näille ioneille, koko lasi toistetaan.
Voi palvella sinua: Tin: rakenne, ominaisuudet, hankkiminen, käyttöToisaalta tetrahydraattisuola, Kalifornia (ei3-A2· 4H2Tai siinä on neljä vesimolekyyliä jokaiselle sarjalle3- Ac2+ EI3-. Tämä muuttaa kiteistä rakennetta, joka muodostaa sen yhtenäisessä monokliinisessä solussa.
Siksi kiteet molemmille suoloille, vedettömille ja tetrahydraateille ovat erilaisia; Erot, jotka voidaan määrittää niiden fysikaalisissa ominaisuuksissa, esimerkiksi fuusiopisteissä.
Fysikaaliset ja kemialliset ominaisuudet
Kemialliset nimet
-Kalsiumnitraatti
-Kalsiuminitraatti
-Nitrocalcita
-Norjalainen salitre ja limesaltpetro.
Molekyylikaava
Rypäle3-A2 tai voi2JOMPIKUMPI6
Molekyylipaino
Anhidro 164 088 g/mol ja tetrahydraatti 236,15 g/mol. Huomaa veden vaikutukset molekyylipainoon, eikä sitä voida halveksittaa, kun se tekee vastaavasta.
Fyysinen ulkonäkö
Kiinteät tai vaaleanharmaat rakeet. Kuutiovalkoiset kiteet tai herkulliset rakeet; toisin sanoen ne imevät kosteutta siihen pisteeseen, että he liukenevat korkean liukoisuuden tuotteen.
Kiehumispiste
Vedetön muoto hajoaa kuumentamalla lämpötilassa, joka estää sen kiehumispisteen määrittämisen; Kun taas tetrahydraattisuolan muodon kiehumispiste on 132 ºC (270 ºF, 405 K).
Sulamispiste
-Anhydra -muoto: 561 ºC - 760 mmHg (1042 ºF, 834 K).
-Tetrahydraattimuoto: 42,7 ºC (109 ºF, 316 K).
Tämä osoittaa, kuinka vesimolekyylit häiritsevät sähköstaattisia vuorovaikutuksia CA: n välillä2+ ja ei3- kiteiden sisällä; Ja siten kiinteä kiinteä sulaa paljon alhaisemmassa lämpötilassa.
Vesiliukoisuus
-Anhydra -muoto: 1212 g/l 20 ºC: n lämpötilassa.
-Tetrahydraattimuoto: 1290 g/l 20 ºC: n lämpötilassa.
Vesi kiteissä tuskin lisää suola liukoisuutta.
Liukoisuus orgaanisiin liuottimiin
-Etanolissa 51,42 g/100 g 20 ºC: n lämpötilassa.
-Metanolissa 134 g/100 g 10 ºC: n lämpötilassa.
-Asetonissa 168 g/100 g 20 ºC: n lämpötilassa.
Happamuus (PKA)
6.0
Tiheys
2,5 g/cm3 25 ° C: ssa (tetrahydraatti).
Hajoaminen
Kun kalsiumnitraattia lämmitetään hehkulamppuun, se hajoaa kalsiumoksidiksi, typpioksidiksi ja happeksi.
Reaktiivinen profiili
Se on voimakkaasti hapettava aine, mutta se ei ole polttoainetta. Nopeuttaa palavien materiaalien sytytystä. Kalsiumnitraatin jakautuminen hienoihin hiukkasiin helpottaa sen räjähdyksiä, kun yhdiste altistuu pitkittyneelle tulelle.
Voi palvella sinua: ei -rautapeiliset seokset: rakenne, ominaisuudet, käytöt, esimerkitSeoksista alkyyliestereissä tulee räjähteitä aiheuttamalla alkyylitraattiestereitä. Kalsiumnitraatin yhdistelmä fosforin, tinakloridin (II) tai muun pelkistävän aineen kanssa voi reagoida räjähtävästi.
Sovellukset
Maatalous
Sitä käytetään kasveissa typen ja kalsiumin lähteenä. Kalsiumnitraatti on hyvin liukoinen veteen ja kasvien juuret imevät helposti. Lisäksi se ei happaita maaperää, koska niiden ionit eivät voi merkittävästi hydrolyisoida.
Sen seosta tulisi välttää fosforia tai sulfaattia sisältävien lannoitteiden kanssa liukenemattomien suolojen muodostumisen välttämiseksi. Hygroskooppisuuden jälkeen se on säilytettävä kuivassa ja tuoreessa ympäristössä.
Sen käyttö on etuna ammoniumnitraatin käyttöön lannoitteena. Vaikka jälkimmäinen yhdiste tuo typpeä kasveihin, häiritsee kalsiumin imeytymistä, mikä voisi tuottaa kalsiumin puutetta kasveissa.
Kalsium myötävaikuttaa kasvin soluseinän rakenteen ylläpitämiseen. Kalsiumvajeen läsnä ollessa kasvien muodostumisen kudokset, kuten juurten kärjet, nuoret lehdet ja puhkeamisen kärjet, osoittavat usein vääristynyttä kasvua.
Ammoniumin väheneminen
Kalsiumnitraatti vähentää haihtuvien rasvahappojen ja fenolisten, fytotoksisten yhdisteiden kertymistä, jotka kerääntyvät soijakasvien jätteiden hajoamisella.
Lisäksi on olemassa kalsiumnitraattisuuntaus ammoniumpitoisuuden vähentämiseksi maaperässä, mikä lisää vedyn vaimennuskykyä.
Betoni
Kalsiumnitraattia käytetään betonin asetusajan lyhentämiseen. Tätä tuotetaan kalsiumhydroksidin muodostumisella ehkä kaksoissiirtymisreaktiolla.
Lisäksi kalsiumnitraatti indusoi rautahydroksidiyhdisteen muodostumisen, jonka betonin suojaava vaikutus vähentää sen korroosiota. Toisin sanoen läsnä oleva rauta voi reagoida betonin peruskomponenttien, kuten itse kalsiumhydroksidin, kanssa.
Kalsiumnitraatti vähentää asetusaikaa sekä betonin vastustusta, johon lisättiin vulkaanista tuhkaa. Kalsiumnitraatin aggregaatin vaikutuksen tutkimiseksi betoniin, kalsiumnitraatin pitoisuuksien lisääntymiseen, välillä 2–10%.
Se voi palvella sinua: molaarinen fraktio: miten se lasketaan, esimerkkejä, harjoituksiaAsetusajan vähenemistä on havaittu suurempaa, samoin kuin betoniresistenssin lisääntyminen, kun kalsiumnitraattipitoisuus nousi 10%: iin.
Jätevesi- tai jätehuolto
Kalsiumnitraattia käytetään vähentämään jäteveden huonoja hajuja vähentämällä rikkivety. Lisäksi monien biologisten lajien eloonjäämistä aiheuttavat orgaaniset anaerobiset olosuhteet kulutetaan.
Kylmä kompressiovalmistelu
Tetrahydraatti kalsiumnitraatti on endoterminen yhdiste, ts. Sillä on kyky absorboida sitä ympäröivästä ympäristöstä. Tämä tuottaa jäähdytyksen ruumiista, jotka ovat kosketuksissa sitä sisältävien astioiden kanssa.
Kompressiot nostavat lämpötilaansa, ja niiden uudistamiseksi riittää sijoittamaan ne pakastimeen
Lateksikoragulaatio
Kalsiumnitraattia käytetään lateksisogulaatiovaiheessa. Se on osa upotusliuosta, ja kun se joutuu kosketukseen lateksin sisältämän liuoksen kanssa, se katkaisee stabiloinnin ja aiheuttaa sen hyytymisen.
Lämmönsiirto ja varastointi
Sulaan nitraattien suoloja, mukaan lukien kalsiumia muiden nitraattien kanssa.
Sovellusmuodot
-Maan kanssa sekoitettu kalsiumnitraatti levitetään 1,59 kg: n pitoisuuteen 30,48 m2, riittävällä kastelulla. Kalsiumnitraatti liuotetaan veteen, mikä mahdollistaa sen imeytymisen kasvin juurten kautta. Hydroponisissa viljelykasveissa se liukenee viljelyveteen.
-Suihkeiden muotoilua kalsiumnitraattia käytetään myös lehtien ja kukkien suihkuttamiseen, mikä on tehokas hoito tomaattikukan mädänä, korkkipiste ja omenan katkera reikä.
-Se lisätään betoniamuotoilevaan seokseen (sementti, hiekka, kivet ja vesi) määrän kalsiumnitraattia ja sen lisäämisen vaikutusta betonin erityisiin ominaisuuksiin; kuten nopeus ja vastus.
-Kalsiumnitraattia lisätään riittävään pitoisuuteen viemärien tai jäännösten huonojen hajujen vähentämiseksi tasolle, jonka hajut ovat siedettäviä ihmisille.
Viitteet
- Kalsiumnitraattien tekniset tiedot. Palautettu: Direct2Farmer.com
- Kalsiumnitraatti. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus

