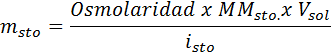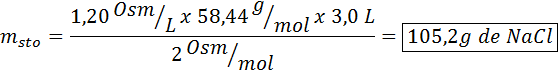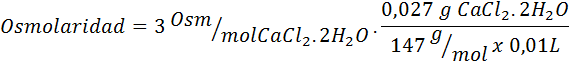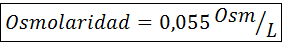Osmolaarisuus
- 1958
- 536
- Eddie Hackett
Mikä on osmolaarisuus?
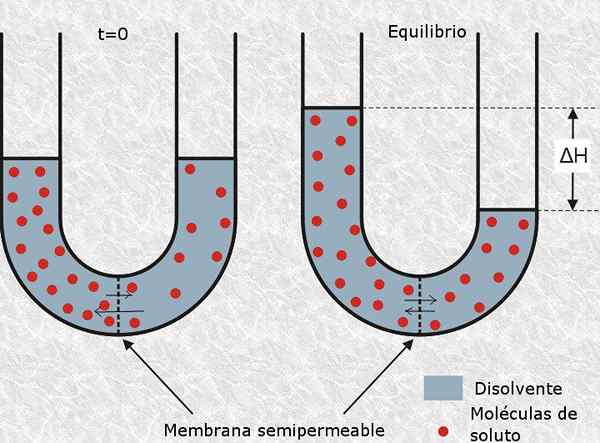
Se Osmolaarisuus Se on pitoisuusyksikkö, joka osoittaa liuoksessa olevien osmoottisesti aktiivisten hiukkasten joukon molaaripitoisuuden. Toisin sanoen osmolaarisuus on osmoottisesti aktiivisten hiukkasten molaarisuus.
on määritelty osmoottisesti aktiivinen hiukkas kyseiseen neutraaliin tai ionimolekyyliin, joka ei voi ylittää puolijohdetta, kuten solukalvo. Tämän tyyppisten hiukkasten läsnäolo tuottaa osmoottisen paineen liuoksessa ja siten sen nimi.
Osmoottisesti aktiivisten hiukkasten moolien lukumäärää kutsutaan Osmolit (OSM -symbolin edustama), joten osmolaarisuus ilmaistaan yksiköinä OSM/L.
Osmolaarisuuden merkitys
Osmolaarisuus on suuri merkitys biologian ja lääketieteen kannalta, koska solujen osmoottinen tasapaino heidän ympäristöönsä on välttämätön niiden selviytymiselle. Esimerkiksi injektointi liuoksella, jolla on erittäin korkea tai erittäin matala osmolaarisuus laskimonsisäisesti, voi helposti aiheuttaa kuoleman potilaalle.
 Osmolaarisuus on olennainen osa lääketieteen ja biologian ratkaisuja
Osmolaarisuus on olennainen osa lääketieteen ja biologian ratkaisuja Toisaalta hyvin yleinen tekniikka, jota solubiologit käyttävät erityyppisten solujen katkaisemiseen, on osmoottisen hajotuksen kautta. Tämä koostuu solujen sijoittamisesta hypotoniseen liuokseen (erittäin matala osmolaarisuus) siten, että liuoksen vesi tunkeutuu niihin osmoosilla ja purskaa ne.
Tämä tekee siitä erittäin tärkeän, sekä lääkäreille että biologeille ja muiden alueiden ammattilaisille, tietäminen, mittaaminen tai tietäminen ratkaisun osmolaarisuuden laskemiseksi.
Voi palvella sinua: Prosentuaalinen keskittyminenErot osmolaarisuuden ja osmolaalisuuden välillä
Kun puhut osmolaarisuudesta, on myös tarpeen puhua osmolaalisuudesta. Osmolaliteetti on samanlainen kuin osmolaarisuus, samalla tavalla kuin moraali on samanlainen kuin molaarisuus.
Kun taas osmolaarisuus osoittaa Osmolien lukumäärä litraa kohti (OSM/L), Osmolaliteetti osoittaa saman, mutta Jokaiselle kilogrammille liuotinta (OSM/kg).
Osmolaliteetti on se etu, että liuoksen tilavuudesta riippuen ei myöskään riipu tiheydestä tai lämpötilasta. Tästä syystä ratkaisulla on sama osmolaliteetti 25 ° C: ssa kuin 37 ° C: ssa. Toisaalta sen 37 ° C: n osmolaarisuus on hiukan alhaisempi kuin sen osmolaarisuus 25 ° C: ssa, johtuen lämpölaajennustilavuuden lisääntymisestä.
Osmolaarisuus on yleensä helpompi mitata kokeellisesti kuin osmolaarisuus. Osmolaarisuus on kuitenkin helpompi laskea ja se on helpompi yksikkö laimennoksille valmistettu.
Kuinka ratkaisun osmolaarisuus lasketaan?
Ratkaisun osmolaarisuuden laskemiseksi on useita tapoja laskettujen tietojen mukaan. Se voidaan laskea:
- Liuenneen aineen ja liuoksen määrät.
- Läsnä olevien liuenneiden aineiden molaarisuus.
- Yksittäiset ionipitoisuudet.
- Liuenneiden aineiden prosenttiosuus m/v.
Kaikissa tapauksissa laskelma perustuu osmolaarisuuden yleiseen kaavaan, joka on:

Missä nOSM Se on ratkaisussa olevien osmolien lukumäärä ja Vaurinko Se on saman litrana ilmaistun tilavuuden tila. Osmolien lukumäärä lasketaan kertomalla liuenneen aineen moolien lukumäärä niiden hiukkasten lukumäärällä, joissa se dissosioituu liuoksessa.
Voi palvella sinua: heterogeeniset seokset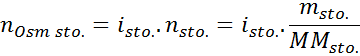
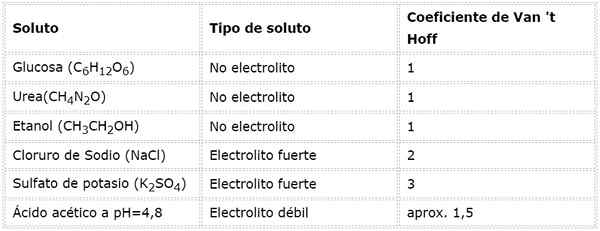
Tässä yhtälössä, nsto Se on liuenneen aineen moolien lukumäärä, msto on sen massa (g), Mmsto Se on sen molaarimassa (g/mol) ja Yllyttäästo Se on liuenneen aineen Van 't -kertoimen. Tällä kertoimella on arvo 1 ei -elektrolyytteille liuenneita aineita (Esimerkiksi glukoosi).
Vahvoille elektrolyytteille, jotka ovat täysin dissosioituneita (kuten natriumkloridi, NaCl), van 't -kerroin on yhtä suuri kuin niiden ionien kokonaismäärä, joissa yhdisteen jokainen mooli dissosiaatioissa.
Esimerkiksi kaliumsulfaatin tapauksessa k2Sw4, jonka dissosiaatioreaktio on:
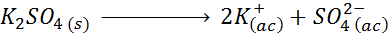
Jokainen liuenen suolan mol tuottaa 3 moolia ionia (2 K -ionit+ Ja 1 niin ioni42-), siis I = n = 3.
Heikkojen elektrolyyttien tapauksessa laskelma on monimutkaisempi, mutta ne määritetään yleensä kokeellisesti. Seuraavassa taulukossa on yhteenveto Van 't Hoffin kertoimista joillekin yleisille liuenneille aineille.
Osmolaarisuuslaskelmaesimerkit
1. Esimerkki 1
Määritä valmistetun liuoksen osmolaarisuus liuottamalla 10 g NaCl: ta ja 10 g glukoosia 100 ml: aan liuosta
Ratkaisu: Tässä tapauksessa kunkin liuenneen aineen osmolit lasketaan erikseen ja lisäävät sitten. Molaarimassat ovat vastaavasti 58,45 g/mol ja 180 g/mol, ja Ve 't -kertoimet ovat 2 ja 1:
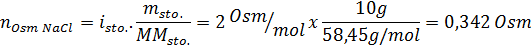
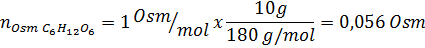
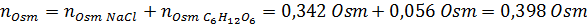
Nyt laskemme osmolaarisuuden kaavaa käyttämällä tietäen, että 100 ml on 0,100L: n:
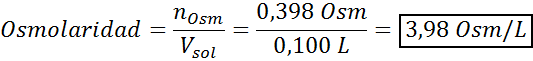
Lopuksi liuoksen osmolaarisuus on 3,98 OSM/L.
2. Esimerkki 2
Määritä 0,05 liuoksen kaliumsulfaattimoolin osmolaarisuus.
Ratkaisu: Jos tiedämme jo liuenneen aineen molaarisuuden, osmolaarisuuden laskeminen on yhtä helppoa kuin tämän pitoisuuden kertominen Van 'T Hoff -kertoimella.
Voi palvella sinua: bentsaldehydi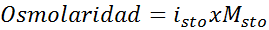
Tässä tapauksessa suolakerroin on 3.
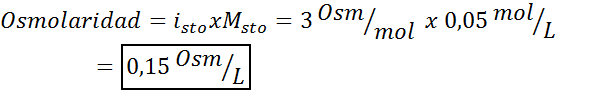
3. Esimerkki 3
Määritä plasmanäytteen osmolaarisuus, joka sisältää 0,125 M natriumioneja, 0,020 M kaliumioneja ja 0,145 kloridi -ionia.
Ratkaisu: Yksittäisten ionien osmolaarisuus on yhtä suuri kuin niiden molaarisuus, koska ionit eivät dissosioi enemmän ja niillä on a I = 1. Tästä syystä tässä tapauksessa on tarpeen moninkertaistaa I = 1 Jokainen keskittyminen ja lisää:
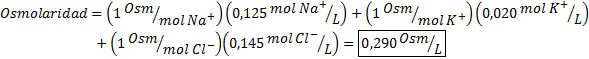
4. Esimerkki 4
Laske liuoksen osmolaarisuus, joka sisältää 27 mg korkkia2.2H2Tai jokaista 10 ml liuosta
Ratkaisu: Cochl -molekyylipaino2.2H2Tai se on 147 g/mol. Liuotettaessa tämä suola on erotettu kahteen vesimolekyyliin ja kolmeen ioniin. Vesimolekyylit eivät kuitenkaan ole osmoottisesti aktiivisia hiukkasia, joten niitä ei oteta huomioon osmolaarisuuden laskemisesta, ja tämän yhdisteen kerroin on 3.

5. Esimerkki 5
Mitä natriumkloridin massaa tarvitaan 3 litran liuoksen valmistamiseksi, jonka osmolaarisuus on 1,20 OSM/L?
Ratkaisu: Tässä tapauksessa, koska liuenneen aineen massaa pyydetään ja meillä on tilavuus ja pitoisuus, riittää osmolaarisuuden kaavan massan puhdistamiseen.