Pyruvaattikinaasirakenne, toiminta, säätely, estäminen
- 1006
- 219
- Shawn Stanton II
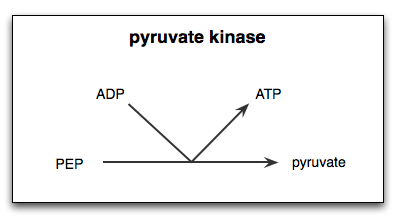
 Reaktio, jota katalysoi entsyymi pyruvato -kinaasi
Reaktio, jota katalysoi entsyymi pyruvato -kinaasi Mikä on kinaasi -pyruvaatti?
Se Pyruvaattikinaasi (Pyk) Se on entsyymi, joka katalysoi glykolyyttisen reitin viimeistä vaihetta, mikä merkitsee fosfoenoliruvaatin (PEP) molekyylin fosfaattiryhmän peruuttamatonta siirtoa ADP pyruvaatti.
Näin myöhemmin tuotettu pyruvaatti osallistuu erilaisiin katabolisiin ja anabolisiin (biosynteettisiin) reiteihin: voidaan dekarboksyloida tuottaa asetyyli-CoA: ta, karboksyloidaan tuottamaan oksalasetaattia, transsamoitua tuottamaan alaniinia, hapettuakseen maitohappoa tai voidaan ohjata kohti glukoneesiä synteesiä varten synteesiä varten. glukoosi.
Koska se osallistuu glykolyysiin, tämä entsyymi on erittäin tärkeä monien organismien hiilihydraattien aineenvaihduntaan.
Esimerkki tiukasti riippuvaisista glykolyysin soluista energian saamiseksi on nisäkkäiden punasolujen, joille tällä reitillä osallistuvilla entsyymeillä voi olla huomattavasti kielteisiä vaikutuksia, nisäkkäiden punasoluissa voi olla huomattavasti negatiivisia vaikutuksia.
Pyruvaattikinaasirakenne
Nisäkkäissä on kuvattu neljä entsyymi pyruvaattikinaasin entsyymi -pyruvaattikinaasin isoformaa:
- PKM1, Tyypillinen lihaksissa
- PKM2, Vain sikiöissä (saman Messenger -RNA: n vaihtoehtoisen prosessoinnin molemmat tuotteet)
- Pkl, läsnä maksassa ja
- PKR, läsnä punasoluissa (molemmat koodaavat sama geeni, Pklr, mutta eri promoottorit kirjoittavat).
Erilaisten entsyymien pyruvaattikinaasin rakenteelle suoritettu analyysi kuitenkin luonnossa (mukaan lukien nämä 4 nisäkkäiden 4) osoittaa suuren samankaltaisuuden yleisessä rakenteessa, samoin kuin aktiivisen kohdan arkkitehtuurin ja sääntelymekanismien suhteen suhteessa.
Voi palvella sinua: Colonial Associations: Ominaisuudet, tyypit ja esimerkitYleensä se on 200 kDa: n molekyylipainon entsyymi, jolle on tunnusomaista tetrameerinen rakenne, joka koostuu 4 identtisestä proteiiniyksiköstä, enemmän tai vähemmän 50 tai 60 kDa, ja jokaisella on 4 domeenia, nimittäin:
- Verkkotunnus kiero- Pieni N-terminaalisessa päässä (puuttuvat bakteerien entsyymeissä)
- Verkkotunnus "-Lla”, Tunnistettu 8 taitettua β -viipaletta ja 8 salia α: n topologialla
- Verkkotunnus "B -”, Asetettu taitettujen beeta -lamina -numero 3 ja alfa -domeenin" A "-domeenin väliin
- Verkkotunnus "C”, Jolla on a+β -topologia
 Entsyymin pyruvaattikinaasi molekyylirakenne
Entsyymin pyruvaattikinaasi molekyylirakenne Erilaisten organismien kinaasipyruvaatin tetrameereissä on havaittu kolme kohtaa: aktiivinen kohta, efektorikohta ja aminohapon sitoutumiskohta. Näiden entsyymien aktiivinen paikka on alueen A ja B välillä, lähellä ”efektoripaikkaa”, joka kuuluu alueelle C.
Tetrámerossa D -domeenit muodostavat "pienen" rajapinnan, kun taas domeenit muodostuvat suuremmasta rajapinnasta.
Kinaasi -pyruvaatin funktio
Kuten jo mainittiin, kinaasi -pyruvaatti katalysoi glykolyyttisen reitin viimeisen vaiheen, toisin sanoen fosfaattiryhmän siirtäminen fosfoenoliruvaatista (PEP) ADP.
Tämän entsyymin katalysoiman reaktion tuotteet ovat erittäin tärkeitä erilaisille aineenvaihduntayhteyksille. Pyruvaattia voidaan käyttää eri tavoin:
- Aerobisissa olosuhteissa, toisin sanoen hapen läsnä ollessa, sitä voidaan käyttää ilmaisen dehydrogenaasi-pyruvaattina kutsutun entsyymin substraattina, dekarboksyloidaan ja muuttua asetyyli-CoA: ksi, molekyyliksi, joka voi päästä Krebs-sykliin mitokondriossa tai osallistu muihin anabolisiin reitteihin, kuten esimerkiksi rasvahappojen biosynteesiin.
- Hapen tai anaerobioosin puuttuessa pyruvaattia voidaan käyttää entsyymi laktaattidehydrogenaasia maitohappojen (hapettumisen) tuottamiseksi prosessin avulla, joka tunnetaan nimellä "maitovirta", ".
- Lisäksi pyruvaatti voidaan muuntaa glukoosiksi glukonogeneesin kautta, transaminaasin alaniinin alaniiniksi, oksalasetaatissa karboksylaasin pyruvaatin jne.
On tärkeää muistaa, että tämän entsyymin katalysoimassa reaktiossa tapahtuu ATP: n nettosynteesi, joka lasketaan glykolyysiin, mikä tuottaa jokaisella glukoosimolekyylin 2 pyruvaattimolekyylillä ja 2 ATP: llä.
Siten tästä näkökulmasta entsyymikinaasi -pyruvaattilla on perustavanlaatuinen rooli monissa solujen aineenvaihdunnan näkökohdissa, niin paljon, jota käytetään terapeuttisena tavoitteena monille ihmisen taudinaiheuttajille, joista erilaiset alkueläimet erottuvat.
Säätö
Kinaasi -pyruvaatti on erittäin tärkeä entsyymi solujen aineenvaihdunnan näkökulmasta, koska se muodostaa viimeisen yhdisteen, joka johtuu glukoosin katabolismista: pyruvaatti.
Sen lisäksi, että kinaasi -pyruvaatti on yksi koko glykolyyttisen reitin (kaksi muuta heksokinaasi (HK) ja fosfrucerachinaasi (PFK)) entsyymiä, kinaasi -pyruvaatti on erittäin tärkeä entsyymi metabolisen virtauksen hallitsemiseksi ja ATP: n tuotannon läpi läpi glykolyysi.
Se aktivoi fosfoenoliruvaatti, yksi sen substraateista (homotrooppinen säätely), samoin kuin muut mono- ja dipfosforyloituneet sokerit, vaikka sen säätely riippuu isoentsyymin tyypistä, jota harkitaan.
Jotkut tieteelliset tekstit viittaavat siihen, että tämän entsyymin säätely riippuu myös sen ”monidominiumin” arkkitehtuurista, koska sen aktivointi näyttää riippuvan joistakin pyörimistä alayksiköiden domeeneissa ja aktiivisen kohdan geometrian muutoksissa.
Monille organismeille kinaasi-pyruvaatin árosteerinen aktivaatio riippuu fruktoosista 1,6-bifosfaatista (F16BP), mutta tämä ei pidä totta vihannesentsyymeihin. Muut entsyymit aktivoidaan myös syklisellä AMP: llä ja glukoosi 6-fosfaatilla.
Voi palvella sinua: Kädet: Ominaisuudet, rakenne, toiminnotLisäksi on osoitettu, että useimpien tutkitujen pyruvaattikinaasien aktiivisuus riippuu suuresti monovalenttisten ionien, kuten kaliumin (K+) ja kalliiden ionien, kuten magnesiumin (Mg+2) ja mangaanin (Mn+2), läsnäolosta, kuten kalliita ioneja (Mn+2), läsnäolosta, kuten magnesiumia (Mg+2) ja mangaania (Mn+2).
Esto
Kinaasi -pyruvaattia estävät pääasiassa fysiologisen efektorin avulla, joten nämä prosessit vaihtelevat huomattavasti eri lajien välillä ja jopa saman organismin solujen ja kudosten välillä.
Monissa nisäkkäissä glukagonilla, epinefriinillä ja AMPC: llä on estäviä vaikutuksia kinaasi -pyruvaattiaktiivisuuteen, vaikutuksiin, jotka voidaan torjua insuliinilla.
Lisäksi on todistettu, että joillakin aminohapolla, kuten fenyylialaniinilla, voi olla vaikutuksia, kuten tämän aivojen entsyymin kilpailukykyiset estäjät.

